Brasero de carboniza.
Cada año por estas fechas llega a nuestras vidas el triste reguero de muertes por intoxicación de monóxido de carbono. El frío y la crisis económica son una mala combinación, a veces letal. Y es que muchas familias, en su afán de calentar sus casas y ahorrar en la factura eléctrica se han visto obligados a buscar métodos alternativos para calentarse, volviendo muchas veces al trastero para desempolvar esa vieja estufa de leña de la abuela, o aquel brasero de carbón olvidado en el desván.
El monóxido de carbono (CO) se forma por una combustión incorrecta de materia orgánica, ya sean provenientes de la madera o combustibles fósiles como los derivados del petróleo (butano, gasolina, gasoil, etc). Ésto puede ser debido a que el tiro (la salida) esté en mal estado, mal hecho o sucio. O por que la combustión se está realizando en una habitación poco ventilada. O por que hay aire que hace que el tiro no funcione bien. El CO también puede provenir de otras fuentes como la indústria o incluso reacciones químicas en nuestro organismo. Es un gas inodoro, incoloro, insípido y no irritante por lo que hace que sea más difícil de detectar. Fue usado antiguamente como veneno para ajusticiar, y es el responsable de la muerte por humo de escape usada por algunos suicidas. También cabe decir que si en la sangre de un no fumador su concentración no debe superar el 3%, ésta puede subir hasta el 9% en el caso de ser fumador.
El drama viene por un hecho muy concreto: el monóxido de carbono tiene aproximadamente 210 veces más afinidad por la hemoglobina que el oxígeno (O2). Esto quiere decir que cada molécula de CO se une 210 veces con más fuerza con la hemoglobina que la de O2 . Vamos que la hemoglobina y el CO padecen lo que denominamos una atracción fatal. Al desplazar la molécula de O2 de la hemoglobina y unirse la de CO, la hemoglobina deja de llevar a cabo su función esencial de llevar oxígeno a todas nuestras células, y acabamos asfixiados. A su vez el CO abandona la hemoglobina de manera muy lenta, evitando que la pueda ocupar de nuevo el O2. La hemoglobina con CO tiene un color rojo cereza, proporcionando también ese color a los intoxicados por CO.

Hemoglobina con sus grupos hemo (verde).
La hemoglobina es una proteína compleja que contiene un grupo de tipo hemo. El grupo hemo a su vez contiene un átomo de hierro (Fe) que es el encargado de “unir” el oxígeno (O2), o en el peor de los casos el monóxido de carbono (CO). Como hemos dicho es la encargada de transportar el O2 a todas nuestras células y de devolver aproximadamente el 10% del CO2 que expiramos al exterior, aunque no a través del grupo hemo (el otro 90% se convierte en bicarbonato por unión con una molécula de agua mediante la enzima anhidrasa carbónica). La hemoglobina está formada por cuatro cadenas, cada una de ellas lleva un grupo hemo, así cada hemoglobina será capaz de transportar hasta cuatro moléculas de O2 o CO (o combinaciones). El O2 se une a la hemoglobina formando la molécula de oxihemoglobina y en el caso de unirse con el CO formará la carboxihemoglobina. El cuerpo necesita oxígeno, especialmente órganos como el corazón, el cerebro y los pulmones, que serán los primeros en padecer el envenenamiento por CO. Los síntomas debido a este tipo de intoxicación estan relacionados con el hecho de que estos órganos intentan superar dicha falta de oxígeno. Se pueden parecer un poco a los síntomas gripales incluyendo fatiga, letargia, somnolencia, malestar, náuseas, vómitos y mareos.
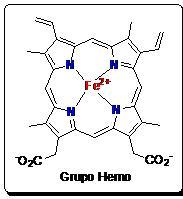
Grupo hemo.
Para superar una intoxicación por CO requiere alejar inmediatamente al sujeto de la fuente de intoxicación. Se administra O2 saturado (al 100%) al paciente para que este empiece a desplazar al CO de los grupos hemo de la hemoglobina por moléculas de oxígeno. En casos muy graves, se aplica la misma terapia en una cámara hiperbárica. Esta ayudará a aumentar la presión relativa del oxígeno en la sangre del paciente, facilitando el cambio de CO por O2 en la hemoglobina. Si la intoxicación no ha sido muy grave tiene muy buen pronóstico, pero si es grave pueden quedar algún tipo de secuelas.
Una manera barata de evitar las intoxicaciones por CO es la instalación de un detector de monóxido de carbono en las habitaciones donde haya posibles fuentes de CO, como estufas o braseros. Son unos aparatos de sencillo manejo e instalación que se pueden comprar por menos de 10 euros por internet y que nos pueden evitar males mayores.
PS. Por el color de la llama del calentador podemos averiguar si tiene una buena combustión o no. Podeis mirar este enlace que os indicará que color es el correcto.
Referencias.
J Emerg Nurs. 2008 Dec;34(6):538-42. doi: 10.1016/j.jen.2007.11.014.
J Neurol Sci. 2007 Nov 15;262(1-2):122-30.
Entrada Carbon monoxide poisoning de la Wikipedia