Catalizadores y
diagramas de energía
Figura CDE-01. En la analogía de la colina, si un reactivo se encuentra en un valle como el de la izquierda no puede reaccionar directamente al producto que se encuentra en el valle de la derecha sin que se tenga que hacer un esfuerzo "escalar la colina". Un catalizador proporciona una ruta mas fácil, una colina menos alta que acelera el viaje entre el valle de la izquierda al valle de la derecha.
En
el artículo anterior pudo verse común un catalizador puede llegar a ser un participante
de la reacción a nivel estequiométrico, aunque otros catalizadores pueden
actuar de manera diferente.
Sin
embargo en términos de la cinética química aún no se respondería a la pregunta
¿Cómo es que un catalizador incrementa la velocidad de la reacción?
Una
respuesta puede dares en términos de la ecuación de Arrhenius. Un catalizador
proporciona una ruta de reacción diferente, ya sea en términos de diferentes
mecanismos de la reacción, ya sea permitiendo que las especie químicas
involucradas se encuentren con mayor facilidad en el mismo momento y lugar del
espacio “incrementar el factor de impacto útiles A”.
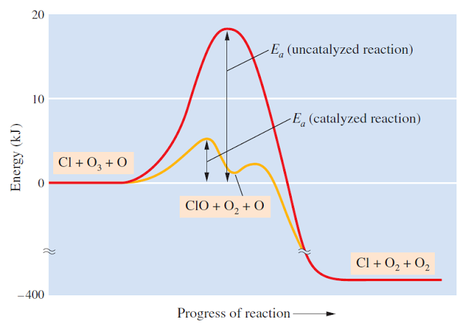
Sin
embargo más comúnmente los catalizadores permiten que los reactivos reaccionen
con niveles de energía más bajos, en otras palabras disminuye la energía de
activación necesaria para que se desencadene la reacción.
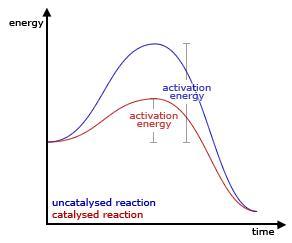
Los
cambios más dramáticos ocurren cuando el catalizador afecta la energía de
activación debido a que afectan la relación matemática a un nivel exponencial.
PRINCIPAL
REGRESAR
