La forma en que el agua interactúa con las proteínas, explica uno de los grandes misterios del plegado de las mismas.
Uno de los grandes desafíos de la biología molecular es comprender cómo las proteínas se pliegan en complejas formas en 3D.
Las proteínas son cadenas de aminoácidos creadas por varias máquinas moleculares dentro de la célula. Cuando se forman por primera vez las proteínas, son rollos aleatorios. En este estado, en el mejor de los casos son benignas, y en el peor tóxicas – los priones que causan problemas tales como la enfermedad de las vacas locas son proteínas deformes.
Pero poco después de esto, ocurre un pequeño milagro. Estas enormes cadenas moleculares cambian rápidamente para auto-ensamblarse en complejas formas en 3D para realizar trabajos dentro de la maquinaria celular.
Esta actuación es tan asombrosa, que merece la pena echarle un vistazo.
Cuando dos aminoácidos se enlazan, pueden tomar aproximadamente diez orientaciones distintas entre sí. Por lo que una cadena de 3 aminoácidos puede tomar 103 formas distintas.
El plegamiento de proteínas más rápido descubierto hasta el momento es una estructura conocida como lámina beta de 3 hebras. Como sugiere su nombre, es una superficie formada a partir de tres hebras de proteínas que se unen entre sí. En total, estas láminas contienen hasta 90 aminoácidos y, por tanto, en teoría pueden tomar cualquiera de las 1090 formas distintas.
Si estas tres formas se probasen a un ritmo de 100 000 millones por segundo, se necesitaría la edad del universo para encontrar el plegamiento correcto. Y aún así, la lámina beta de 3 hebras se forma en apenas 140 nanosegundos.
Sería menos sorprendente dejar unos pocos trozos de metal y plástico en tu patio trasero y descubrir a la mañana siguiente que se han ensamblado para formar un ordenador portátil.
Hay varias sugerencias sobre cómo el plegamiento de proteínas hace esta magia. Una de las ideas más prometedoras es la idea de que la evolución ha seleccionado sólo aquellas proteínas que colapsan de forma natural en la forma requerida. Para hacer esto, la energía de la forma final debe ser menos que la energía inicial y todos los pasos intermedios.
Esto significa que el paisaje de energía de este sistema debe estar en forma de embudo. Mediante esta forma de pensar, el plegamiento de proteínas funciona debido a que, al explorar el espacio de posibles formas, la estructura “cae” a través del embudo.
Pero hay un problema. Si esta fuese toda la historia, las proteínas deberían ser más estables a bajas temperaturas. Pero no lo son. Una propiedad bien conocida de muchas proteínas es que su estructura colapsa conforme cae la temperatura. Por lo que cualquier modelo de plegamiento de proteínas tiene que tener esto también en cuenta.
Hoy, Olivier Collet de la Universidad de Nancy en Francia ha descubierto qué pasa y la clave, según dice, es el agua.
Señala que el plegamiento de proteínas no tiene lugar en aislamiento, sino en una solución. Por lo que las cadenas de aminoácidos están rodeadas por moléculas de agua. A poca distancia, forman una capa alrededor de la cadena de proteínas. Lo que Collet ha hecho es estudiar el comportamiento de las moléculas de agua de esta primera capa.
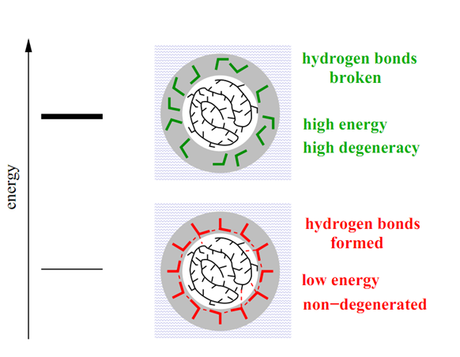
Collet dice que las moléculas de agua forman enlaces de hidrógeno con los aminoácidos. Siempre que la temperatura se mantenga relativamente alta, los enlaces de hidrógeno se rompen y forman de nuevo constantemente, y el plegamiento tiene lugar de la forma rápida habitual.
Pero si la temperatura baja, os enlaces de hidrógeno se hacen permanentes, permitiendo que las proteínas tomen nuevas configuraciones de baja energía. Esto cambia drásticamente el paisaje de energía, creando valles adicionales que se corresponden con estas nuevas formas de baja energía. Por lo que en lugar de caer a través del embudo de energía, la proteína queda atrapada en otro valle que corresponde a una forma incorrecta.
Ésta es una idea útil. Explica claramente el problema de la temperatura dentro de la teoría existente.
También sugiere que podría llegar una nueva comprensión del plegamiento de proteínas de una mejor comprensión de las propiedades del agua a estas diminutas escalas.
Como veíamos la semana pasada, la red de enlaces entre moléculas de agua confinadas a esta escala, tiene un impacto drástico en su comportamiento. Puede que incluso haya coherencia cuántica asociada a estos enlaces, lo cual, inmediatamente sugiere una nueva forma de aproximarse a este problema – tratarlo como un tipo de computación cuántica.
Esto podría abrir una vía de trabajo completamente nueva, y estaremos esperando. ¡Un tema fascinante!
Artículo de Referencia: arxiv.org/abs/1101.5502: How Does The First Water Shell Fold Proteins So Fast?
Artículo traducido y posteado en Ciencia Kanija, el original se publicó en Technology Review.
