Una de las contradicciones más flagrantes y evidentes de los libros de texto de 4º de ESO y Bachillerato se encuentra con facilidad en los de Química o Física, en 4º o 1º, y de Química, en 2º de Bachillerato. A veces, los docentes caen en este error con facilidad, incluso en estudios superiores (no es el caso de mi profesor de Química Física en el curso 2008/2009, una persona realmente lúcida). Muchos alumnos acaban su carrera universitaria de ciencias o ingeniería con ideas erróneas sobre las constantes de equilibrio.
Uno puede abrir uno de esos libros por el tema de Equilibrio Químico, quizá Equilibrio a secas, y encontrar alguna reacción de ejemplo:
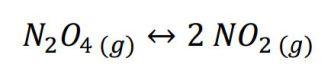
Esto es una reacción reversible. Si esperamos un tiempo suficientemente alto a una temperatura dada, dejaremos de apreciar cambios en las concentraciones de N2O4 y NO2. Así, los libros definen una constantes «de equilibrio», Kc, de la siguiente forma:
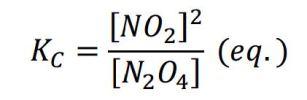
Es decir, un cociente donde el alumno debe introducir la concentración de cada especie cuando se ha alcanzado el equilibrio, siempre en mol/L. Definida así, Kc no puede sino estar expresada en mol/L, ¿verdad?
Seguidamente, se define una constante de equilibrio alternativa, únicamente cuando hay gases implicados, con presiones parciales:
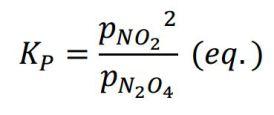
La instrucción consiste en sustituir p en bares… o en atmósferas. A esto último es posible objetar, siendo la presión estándar igual a 1 bar (IUPAC), pero sigue siendo una definición posible. Definida así, Kp no puede sino estar expresada en unidades de presión.
Y aquí llega lo divertido: decimos a los alumnos que Kc y Kp son adimensionales. Si en ese momento recuerdan la lección del Tema 1 de 4º de ESO, relacionado con las magnitudes y sus unidades, los estudiantes pueden quedar perplejos. Pero lo dejamos en un «esto es así porque es así», que es un motivo muy científico.
Después de todo, ¿cómo no va a ser adimensional Kp, cumpliendo esta relación?:
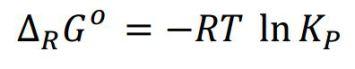
(La cumple si hablamos de gases ideales y si las unidades de R son coherentes, claro.)
El argumento de un logaritmo no va a tener unidades. Pero, al mismo tiempo, Kc y Kp se relacionan mediante la ecuación:
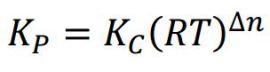
donde la constante de los gases (R) y la temperatura (T) tienen unidades. Pero… ¡Kc y Kp no! ¿[1] = [1] · [P·V/n]^(número entero)?
No se sostiene por ningún lado. Y, sin embargo, los alumnos que están cursando Bachillerato me insisten en el carácter adimensional de Kc y Kp. Después lo compruebo en sus libros de texto: sí, eso les enseñan. Divide bar^2 entre bar y obtén un resultado adimensional.
Magia.
Tratamiento correcto
En primer lugar, empezar por la seudoconstante de equilibrio en términos de concentración (eso es Kc, una seudoconstante) puede no ser lo más adecuado. El tema de Equilibrio debe proceder, no preceder, al de Termoquímica, de tal suerte que el alumno esté familiarizado con la energía libre de Gibbs estándar de una reacción.
La IUPAC llama K, constante de equilibrio termodinámica, a aquella que cumple:
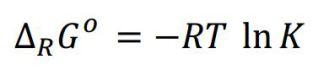
Alternativamente, podemos escribir Kº o Kf, para evitar la confusión con otras constantes. Este es el principio, no el final. Esto es la definición de constante de equilibrio. Y, así definida (según la IUPAC), sí es adimensional.
¿Cómo calcularla si no disponemos de la energía libre de Gibbs? Si hablamos de gases ideales, K coincide con Kp definida tal que así:
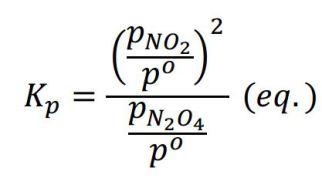
donde pº, la presión estándar, es 1 bar. Esta constante sí es adimensional. Su valor coincide con el de la Kp formulada antes si esta última se calcula y se expresa en bares. Con la constante de los gases, la temperatura y el aumento en el número de moles, obtenemos Kc en mol/L.
Pero, además, es posible hablar de una Kc adimensional:
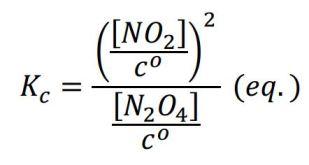
donde cº, la concentración estándar, es 1 mol/L. Presentar la seudoconstante Kc debería ser el último paso, no el primero.
No podemos pretender que Kc y Kp sean adimensionales si las definimos únicamente en términos de las concentraciones y las presiones parciales de los componentes, respectivamente prescindiendo de dividirlas por la concentración y la presión estándares. Podemos usar las Kc y Kp dimensionales, definidas como al inicio: es una opción. Pero si uno quiere ahorrarse las unidades, debe definirlas de este modo. No se puede tener todo.


