La materia es todo lo que ocupa un lugar en el espacio. Es todo aquello que se forma a partir de átomos o moléculas, con la propiedad de estar en estado sólido, líquido o gaseoso. Son ejemplos de materia las piedras, la madera, los huesos, el plástico, el vidrio, el aire y el agua. Al observar un paisaje pueden verse pájaros, árboles, un río, un caballo pastoreando, flores, etc. Todas esas cosas forman parte de la naturaleza y se pueden ver y tocar. Esa característica común (visible y palpable) que tienen todos los objetos se denomina materia. Es decir, la materia es lo que forman las cosas que tocamos y vemos.
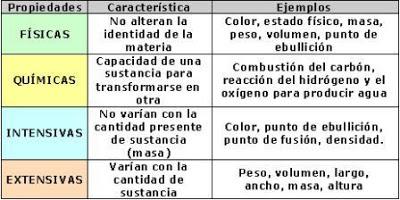
La materia tiene volumen porque ocupa un lugar en el espacio. Además tiene masa, que es la cantidad de materia que posee un objeto y que se puede medir con una balanza. La materia, a diferencia de los objetos o cuerpos, no está limitada por la forma ni por el tamaño. A su vez, los objetos o cuerpos (por ejemplo una caja) pueden estar construidos por diferentes materiales (cartón, metal, madera, plástico). Por otra parte, un mismo objeto puede estar formado por uno o varios materiales (caja de madera con tapa de plástico y cerradura de metal). También, diferentes objetos pueden estar fabricados con el mismo tipo de material (balde, pelota y botella de plástico). La materia se encuentra en tres estados diferentes de agregación: sólido (hierro, madera), líquido (agua de mar) y gaseoso (aire atmosférico). En estos tres estados de agregación se observan las siguientes características:
1) La materia está formada por pequeñas partículas.
2) Esas partículas están en constante movimiento (en los gases más que en los líquidos y sólidos).
3) Hay fuerzas de atracción entre las partículas que forman la materia (en los sólidos más que en líquidos y gases).
Esas partículas, que son pequeñísimas y que forman parte de la materia se denominan átomos.
ÁTOMO
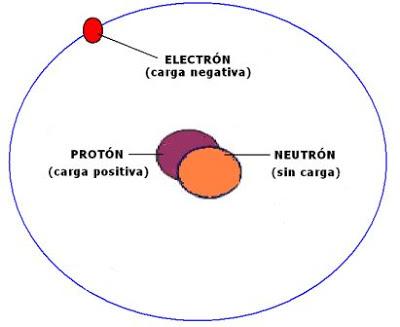
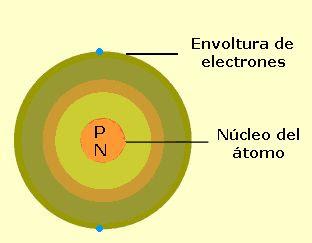
Un átomo es la menor cantidad de un elemento químico que tiene existencia propia, y que no es posible dividir mediante procesos químicos. Un átomo es tan pequeño que una sola gota de agua contiene más de mil trillones de átomos. Los átomos están formados por un núcleo que contiene dos tipos de partículas: los protones (tienen carga eléctrica positiva) y los neutrones (sin carga eléctrica). Ambas partículas tienen una masa similar. Alrededor del núcleo se encuentran los electrones, que tienen carga eléctrica negativa y una masa muchísimo más pequeña que la correspondiente a los protones y neutrones. El átomo es eléctricamente neutro, ya que tiene tantos electrones como protones hay dentro del núcleo. Los electrones giran alrededor del núcleo en zonas llamadas orbitales, que se agrupan en niveles de energía. Los electrones que giran más cercanos al núcleo del átomo tienen menor energía que aquellos que lo hacen alejados del núcleo. Los electrones van llenando los orbitales desde la zona más cercana al núcleo hacia la más alejada. De esa forma, el último nivel que contenga electrones puede estar completo o incompleto.Cuando el último nivel orbital está incompleto, el átomo es inestable y tiende a completarlo para ganar estabilidad. Para ello puede dar, recibir o compartir electrones con otros átomos. Es así como se forman agrupaciones de dos o más átomos. Un átomo puede prestarle a otro átomo uno o varios electrones. De esa forma ambos adquieren carga eléctrica. El átomo que gana electrones (queda cargado negativamente) se denomina anión. El átomo que pierde electrones (queda cargado positivamente) se llama catión. Tanto el anión como el catión reciben el nombre de "iones". Es decir, un ion es un átomo cargado eléctricamente, sea en forma positiva o negativa.
Esquema de un átomo
John Dalton propuso la denominada “Teoría Atómica” en el año 1808, donde se postula:
1- La materia está formada por partículas indivisibles y pequeñas llamadas átomos.
2- Un elemento químico es un tipo de materia formada por una sola clase de átomos.
3- Cuando los átomos de dos o más elementos se combinan forman compuestos en una razón fija de números enteros.
4- Durante una reacción química, ningún átomo desaparece o se transforma en átomos de otro elemento.
La teoría atómica dio lugar a tres leyes de la materia.
-Ley de la conservación de la masa: durante los cambios químicos no se producen modificaciones apreciables en la masa.
-Ley de la composición constante: un compuesto contiene siempre los mismos elementos y en igual razón por peso, independientemente de su origen.
-Ley de las proporciones múltiples: cuando dos elementos forman dos compuestos distintos, la relación de masa de los elementos en un compuesto está asociada a la relación de masa en el otro compuesto a través de un número sencillo y entero.
MOLÉCULA
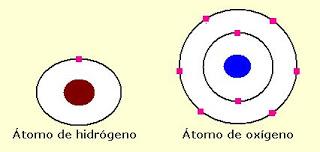
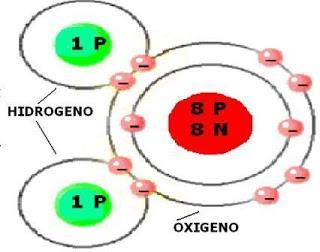
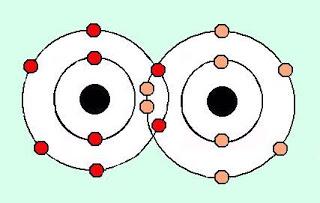
Es la menor porción de una sustancia que puede existir en estado libre y conservar las propiedades de dicha sustancia. Por ejemplo, la menor porción de agua que puede existir en estado libre y conservar las propiedades del agua es la formada por 1 átomo de oxígeno y 2 de hidrógeno. La molécula es una estructura formada a partir de la unión de dos o más átomos que comparten electrones. A temperatura ambiente hay moléculas sólidas (cloruro de sodio o sal común), líquidas (agua) y gaseosas (dióxido de carbono). En síntesis, la materia está formada por partes muy pequeñas llamadas átomos. Los átomos se reúnen para constituir moléculas. A su vez, las moléculas se unen para formar sustancias. El suelo, el aire y el agua no tienen vida. Pertenecen al mundo mineral o inorgánico. La materia que forma el agua, suelo y aire se llama materia inorgánica. El árbol, el caballo y el humano, entre otros, pertenecen al mundo de los seres vivos. La materia que los forma se llama materia orgánica. Los compuestos o sustancias orgánicas son aquellos que comprenden a los hidrocarburos y sus derivados. Los hidrocarburos son elementos formados por átomos de carbono y de hidrógeno. Las sustancias inorgánicas comprenden a los restantes compuestos químicos que, en general, se encuentran en la naturaleza como minerales.
Molécula de agua
Molécula de oxígeno
PROPIEDADES DE LA MATERIA
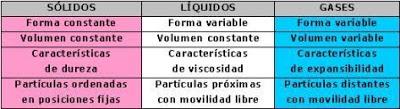
 ESTADOS DE LA MATERIA
ESTADOS DE LA MATERIAEl estado en que se encuentra la materia (sólido, líquido y gaseoso) depende de la energía que poseen las partículas (átomos, moléculas y iones) que constituyen la materia, y de las fuerzas de atracción que existen entre ellas. Además, también depende de las condiciones de temperatura y presión a las que están sometidas esas partículas.
Estado sólido
Las partículas que forman los sólidos se atraen fuertemente, están cerca unas de otras y dispuestas de manera ordenada, lo que le dan la característica de ser estructuras rígidas. Tienen poco espacio para moverse, ya que solo pueden hacerlo vibrando en posiciones fijas. Esta particularidad les da la característica de tener forma y volumen constantes.Estado líquido
Las partículas que forman los líquidos se atraen parcialmente y tienen más libertad para moverse que en los sólidos, pero no llegan a separarse de las demás, por lo que conservan su volumen. Esas partículas disponen de más espacio y pueden deslizarse unas sobre otras con facilidad. Esto explica por qué los líquidos tienen forma variable, adoptando la del recipiente que los contiene. Una característica de los líquidos es la fluidez, ya que pueden trasladarse hacia otros lugares y atravesar orificios muy pequeños. Otra propiedad es la viscosidad, debido a que poseen cierta dificultad para desplazarse a raíz del rozamiento de sus partículas.
Estado gaseoso
En los gases prácticamente no existen fuerzas de atracción que mantengan unidas las partículas que los forman. Es por eso que sus partículas están muy separadas entre sí y existe más espacio vacío que en los líquidos o en los sólidos. Ello permite que se muevan con mayor facilidad, al azar y con bastante rapidez. Así se explica que los gases tengan una forma y un volumen variables y sean expansibles, es decir, ocupen todo el espacio disponible.
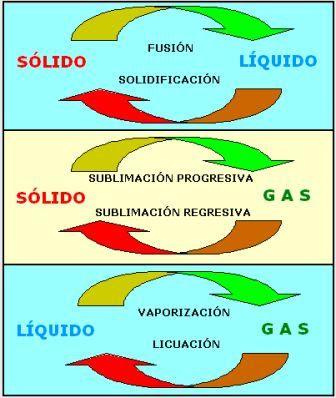
Cambios de estado de la materia
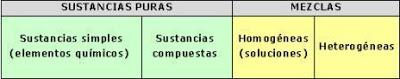
La materia se clasifica en sustancias puras y mezclas. Las sustancias puras, que a su vez pueden ser simples y compuestas, se caracterizan por tener composiciones fijas y responder a propiedades constantes. Las sustancias compuestas pueden separarse mediante procedimientos químicos.
Las mezclas están formadas por dos o más sustancias puras y se dividen en homogéneas y heterogéneas. Los componentes de una mezcla se pueden separar utilizando procesos físicos.
Una sustancia es cualquier variedad de la materia de aspecto homogéneo que comparte determinadas propiedades, como el color, la densidad, la temperatura de ebullición y la temperatura de fusión, entre otras. Esto hace que cada sustancia pueda distinguirse de otra sustancia.
Las sustancias simples están formadas por átomos de un solo elemento que no pueden fragmentarse en elementos más simples utilizando métodos físicos o químicos comunes. Son sustancias simples los elementos que figuran en la tabla periódica de los elementos, como el oxígeno, el carbono, el nitrógeno, el azufre, etc.
Las sustancias compuestas son aquellas sustancias puras que contienen dos o más elementos fijos, con lo cual siempre tienen los mismos elementos en su composición. Las sustancias compuestas se representan por medio de fórmulas químicas. La molécula del agua está formada por dos átomos de hidrógeno y uno de oxígeno. El dióxido de carbono posee dos átomos de oxígeno y uno de carbono. Además del agua y del dióxido de carbono, son ejemplos de sustancias compuestas el metano, el cloruro de sodio, la glucosa, la urea, el amoníaco y el alcohol etílico.
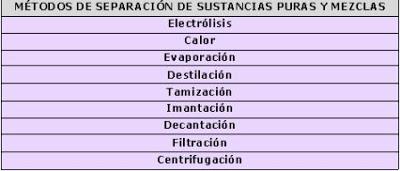
Para separar los elementos de una sustancia compuesta se puede recurrir a procesos químicos. Por ejemplo, sometiendo a elevadas temperaturas al dióxido de mercurio es posible obtener los elementos constituyentes de dicha sustancia. Otra forma de separación es la electrólisis, que consiste en someter a un determinado compuesto a una corriente eléctrica. La electrólisis del agua separa sus elementos constituyentes, obteniéndose los gases hidrógeno y oxígeno. La utilización de procesos químicos de separación produce destrucción de las sustancias componentes.
MEZCLAS
Son materiales que se forman al combinar dos o más sustancias puras, sin que ello ocasione cambios químicos en esas sustancias. Por medio de métodos físicos, las mezclas pueden separarse de sus componentes sin producir alteración en los mismos. Existen dos tipos de mezclas, las homogéneas y las heterogéneas.
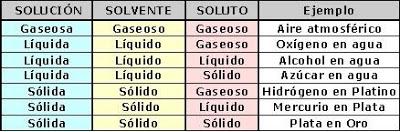
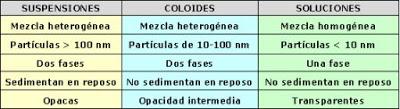
Las mezclas homogéneas son soluciones, formadas por un solvente generalmente en mayor proporción y uno o más solutos en cantidades menores. Tienen la misma composición en toda la muestra por lo que son uniformes, con lo cual presentan una sola fase. Sus partículas, que no pueden distinguirse a simple vista ni aún bajo el microscopio, se mueven al azar y de manera constante. Tienen un tamaño entre 0,1 y 10 nanómetros (nm) y se encuentran dispersadas como moléculas, átomos o iones.
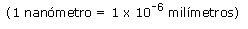
La evaporación y la destilación son métodos para separar los componentes de una mezcla homogénea. Cuando la solución está formada por un líquido y un sólido se emplea la evaporación. Una solución salina puede separarse evaporando el líquido, que se recupera condensando el vapor. El sólido, en este caso la sal, queda depositado en el fondo del recipiente. Si la mezcla homogénea está formada por dos líquidos se utiliza la destilación, en la medida que ambos componentes tengan diferente punto de ebullición. La sustancia más volátil se desprenderá primero de la mezcla, que se recupera por condensación. Mediante la destilación se puede separar el alcohol que forma parte del vino.
Los coloides son mezclas heterogéneas cuyas partículas, entre 10 y 100 nanómetros, son más pequeñas que las correspondientes a las suspensiones, pero más grandes que las moléculas que forman las soluciones. Un coloide es un sistema formado por una fase continua, en general líquida, y otra fase dispersa a modo de partículas, normalmente sólidas. Sus partículas no se separan si están en reposo y poseen una opacidad menor que las suspensiones. Los coloides también tienen una fase dispersa representada por partículas del tamaño antes indicado que se distribuyen en una fase dispersante, similar al solvente de las soluciones. Son mezclas heterogéneas coloidales la sangre, la leche, el flan, las gelatinas, el vino, la cerveza, la tinta china, las pinturas, la mayonesa, la clara de huevo, el humo y la neblina.
-Tamización: procedimiento donde las partículas sólidas se pueden separar a raíz de su diferente tamaño. Se utilizan coladores con orificios de distintas dimensiones. Por este método, por ejemplo, se pueden separar pequeñas rocas mezcladas con arena gruesa y con sal.
-Imantación: cuando uno de los componentes de la mezcla es atraído por los imanes, no así la otra, por ejemplo partículas de hierro mezcladas con arena.
-Decantación: se utiliza en mezclas heterogéneas de dos líquidos o de un sólido en un líquido. Este método físico se basa en las diferentes densidades de los componentes. La mezcla se deja reposar hasta que descienda uno de los constituyentes y pueda extraerse. Las suspensiones se separan por decantación, tal los casos del agua en aceite o el agua con tierra.
-Filtración: este método permite separar un sólido de un líquido, haciendo pasar la mezcla por un filtro de papel donde queda retenido el sólido.
-Centrifugación: procedimiento donde se separan materiales de distinta densidad mediante rotación sobre un eje fijo a velocidad rápida y constante. Los componentes más densos se ubican en el fondo del recipiente o tubo de la centrífuga.