
Este fin de semana, pusieron en la tele la película G.I. Joe, y recordé algo que alguno de vosotros me comentó hace tiempo, sobre la batalla final (alerta: mini-spoiler). La base de Cobra está sumergida en el Ártico, y sobre ella está la superficie congelada del mar. Durante la batalla, el hielo de la superficie se rompe, y vemos enormes bloques de hielo hundiéndose, que ponen en peligro a los contendientes. Sí, habéis leído bien: el hielo se hunde en el agua.
Bueno, creo que no sorprenderé a nadie si digo que el hielo flota en el agua. Es algo que todos hemos visto de una forma u otra, aunque sea en una bebida. El motivo es muy simple: el hielo es menos denso que el agua, dado que cuando ésta se congela, aumenta su volumen. Eso es algo que a todos nos enseñaron de pequeños. Y posiblemente muchos de vosotros lo hayáis visto directamente. ¿A alguno se le ocurrió alguna vez en verano, meter una botella de agua en el congelador para que se enfriara rápido, y olvidarse luego de ella? Si es así, sabréis que el aumento de volumen del agua al congelarse, es capaz de romper la botella.
Esto que todos sabemos, y que nos parece tan normal, es en realidad un comportamiento anómalo. De hecho, se le llama «comportamiento anómalo del agua». ¿Por qué es anómalo? Como sabéis (también nos lo enseñaron en el colegio), el calor dilata los cuerpos. Eso quiere decir que normalmente, un cuerpo disminuye su volumen a medida que disminuye la temperatura, Es decir, su densidad aumenta. Sin embargo, el agua tiene una peculiaridad. Por encima de los 4 ºC, se comporta como cualquier otro líquido: aumentando el volumen al calentarse, y disminuyéndolo al enfriarse. Pero por debajo de 4 ºC, al agua se dilata a medida que se enfría. Al llegar a 0 ºC se produce el cambio de estado (de líquido a sólido) y el volumen aumenta de forma muy brusca. Una vez en estado sólido, el hielo se comporta normalmente, disminuyendo su volumen a medida que la temperatura desciende. Pero este descenso es mucho más gradual, de forma que incluso un bloque de hielo a -90 ºC (la temperatura natural más baja jamás registrada a nivel del suelo, es de -89,2 ºC), sigue teniendo menos densidad que el agua a 0 ºC.
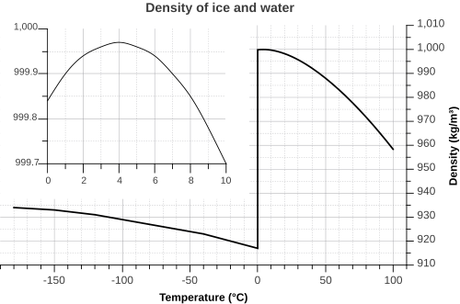
Aquí podéis ver una gráfica con la variación de densidad del hielo/agua con respecto a la temperatura. Como veis (y si no, os lo cuento yo), entre 0 ºC y 4 ºC, la densidad del agua se mantiene en torno a 1 kg/l (1.000 kg/m3). Justo por debajo de 0 ºC, la densidad disminuye bruscamente a 0,917 kg/l. A medida que disminuye la temperatura, la densidad aumenta poco a poco, pero nunca llega a alcanzar la del agua a 0 ºC (ni siquiera alcanza la del agua a 100 ºC). Es decir, la densidad del hielo es siempre menor que la del agua. Por tanto, el hielo siempre flota en el agua.
Esta anomalía es de vital importancia. Cuando lagos, ríos y mares se congelan en invierno, se forma una capa de hielo en la superficie. Esto impide que se congele toda la masa de agua, permitiendo que el ecosistema de su interior pueda sobrevivir. Y recordad, que la vida comenzó precisamente en el mar.
Así que ya sabéis. Cada vez que os toméis una copa y veáis flotar los cubitos de hielo (sí, aunque la densidad del alcohol etílico es de 0,789 kg/l, las bebidas como el whisky, el vodka o la ginebra, tienen una densidad mayor que la del hielo), pensad que ese peculiar fenómeno permite que estéis ahí, disfrutando de la misma.
