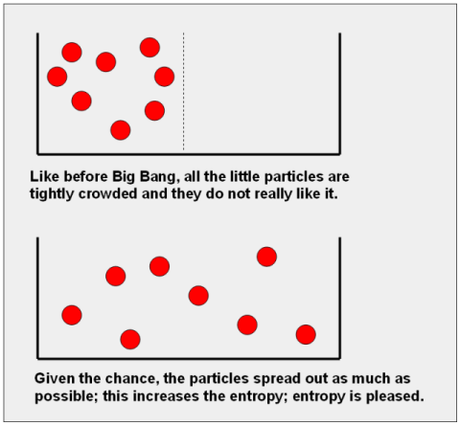
Entropía en química Introducción a la entropía química Microestados y entropía química Cambio de entropía de un sistema químico Entropia estandar La segunda ley de la termodinámica en términos matemáticos Entropía de la reacción y entropía del sistema Entropía de los alrededores Microestados y entropía química
La probabilidad de un microestado se determina por la cantidad de microestados semejantes que pueden describirse de manera teórica. Pongamos un ejemplo sencillo.
Digamos que tenemos una caja aislada en la cual tenemos dos partículas ideales de energía cada una completamente identificable. El primer estado es el menos probable:
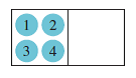 Ahora
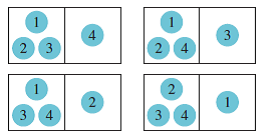
si dejamos que pase el tiempo debido a la ley cero de la termodinámica, una partícula
de energía fluye a través de una membrana permeable que separa las dos mitades
de la caja aislada. Sin embargo como cualquiera de las partículas que fluya nos
arrojará un sistema de las mismas características obtendremos cuatro
microestados completamente equivalentes.
Ahora
si dejamos que pase el tiempo debido a la ley cero de la termodinámica, una partícula
de energía fluye a través de una membrana permeable que separa las dos mitades
de la caja aislada. Sin embargo como cualquiera de las partículas que fluya nos
arrojará un sistema de las mismas características obtendremos cuatro
microestados completamente equivalentes.
Del mismo modo cuando se alcanza el equilibrio, cada uno de los anteriores poseerá diferentes posibilidades de formar el microestado de equilibrio el cual puede ser cualquiera de los siguientes.
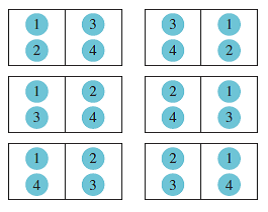
Aunque es un esquema simple lo que nos interesa es que los microestados más numerosos son los que tienden al equilibrio, y por ello el equilibrio es más probable que el desequilibrio. La variable S mide esa dispersión en términos de la energía y la temperatura, es decir un sistema tendrá un mayor valor para S a medida que su energía se encuentre más dispersa.
Así el valor de S en la caja donde la energía estaba acumulada en un solo lugar será el mínimo, mientras que el valor de S para cualquiera de los microestados equivalentes en el equilibrio es máximo.
El 1868 Boltzmann demostró que la variable S estaba directamente relacionada a la cantidad de microestados teóricamente posible mediante un Ln adimensional de la cantidad de microestados multiplicado por una constante de proporcionalidad que le da las unidades a la variable de entropía S
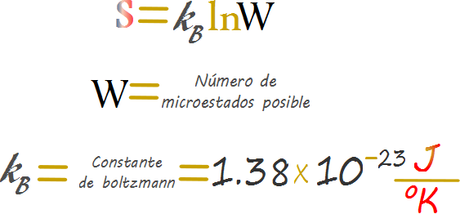
Al igual que la entalpia la entropía es una variable de estado que depende de las condiciones iniciales y finales de un sistema que adicionalmente no puede definirse de manera absoluta para un sistema que no cambia.
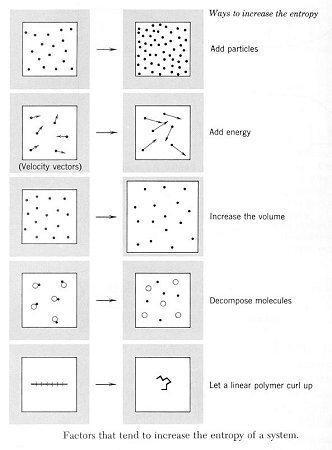
Figura MEQ-05. Formas de incrementar la entropia de un sistema "de arriba hacia abajo": añada mas partículas; incremente la energía del sistema; incremente el volumen del sistema/disminuya la presión del sistema; Descomponga macromoléculas; convierta un polímero lineal en uno enroscado.
Es decir, la ecuación anterior se define en torno al conocimiento adimensional de la cantidad absoluta de microestados probables de manera estadística en un sistema, lo cual implica poder contarlos todos y cada uno. PRINCIPAL REGRESAR