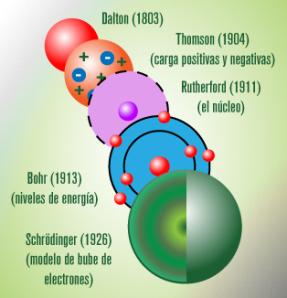
En este artículo voy a hablar de los modelos atómicos que hubo a lo largo de la historia.
Los modelos atómicos son teorías que pretenden explicar como es el interior de los átomos y como se comportan los mismos.
El primer modelo atómico conocido es el que propusieron los griegos en el siglo IV a.C afirmaron que la materia estaba constituida por átomos. Los griegos definían el átomo como esferas macizas indestructibles, átomo en griego significa indivisible. Aunque este modelo atómico no sea correcto aún se tiene en cuenta por ser el primer modelo atómico propuesto.Siglos más tarde Dalton en 1805 recogió la idea griega del átomo y publicó un modelo atómico a base de 4 postulados que estaba expresado mediante unas leyes: conservación de la materia, proporciones definidas, proporciones múltiples, proporciones recíprocas ...En esencia lo que dice el modelo atómico de Dalton es lo siguiente:
- La materia está formada por átomos que son esferas macizas indestructibles.
- Los átomos de un mismo elemento son semejantes en peso y tienen propiedades semejantes.
- Los átomos de distintos elementos son distintos en peso y tienen propiedades distintas.
- Cuando átomos de distintos elementos reaccionan entre si lo hacen en proporciones muy sencillas dando lugar a átomos de otros elementos.
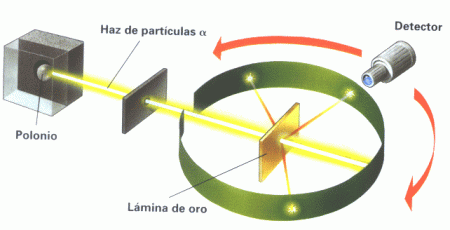
En 1911, Ernest Rutherford realizó que consistió en bombardear partículas alfa a través de una lámina de oro y observó que ocurría lo siguiente: había rayos que rebotaban contra la lámina, otros que se desviaban, y otros que atravesaban la lámina de oro. Los rayos que rebotaban lo hacían porque chocaban contra el núcleo, pero no lo tocaban en su centro y los que atravesaban la lámina de oro era porque no tocaban el núcleo. En la siguiente imagen se ilustra el experimento de Rutherford.
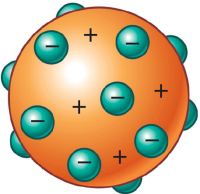
De este experimento pudo concluir que el átomo está prácticamente vacío, la mayor parte de la masa del átomo se encuentra concentrada en el núcleo, muy pequeño que está cargado positivamente (tiene protones). Alejados del núcleo se encuentran los electrones que giran al rededor del núcleo, constituyendo la corteza del átomo. Definió el átomo como un sistema solar en miniatura. En la imagen siguiente se ilustra esta idea.
 Para hacernos una idea de lo que quiere decir el modelo atómico de Rutherford: Si construyésemos una pista de toros de dos kilómetros y colocásemos una canica en el centro, esa canica sería el núcleo y en los límites de la plaza de toros estarían los electrones girando alrededor del núcleo, constituyendo la corteza del átomo.
Para hacernos una idea de lo que quiere decir el modelo atómico de Rutherford: Si construyésemos una pista de toros de dos kilómetros y colocásemos una canica en el centro, esa canica sería el núcleo y en los límites de la plaza de toros estarían los electrones girando alrededor del núcleo, constituyendo la corteza del átomo.Esta explicación fue rápidamente aceptada pues era muy sugerente que lo más grande fuese similar a lo más pequeño.
Sin embargo una serie de experiencias, fenómenos y leyes inexplicables mediante este modelo hicieron que tuviera que ser superado. La teoría cuántica, la teoría electromagnética, las rayas espectrales, etc movieron a Niels Böhr a publicar su modelo según el cual los electrones se disponen alrededor del núcleo según niveles de crecientes.
Muy poco tiempo después el principio de indeterminación de Heisenberg obligó a desechar este modelo publicándose el modelo de orbitales según el cual los electrones no describen trayectorias definidas sino que ocupan unas zonas de probabilidad de encontrarlos a las que se da el nombre de orbitales.
Resumiendo todas estas ideas:
La materia está constituida por átomos y estos tienen un núcleo y una corteza. La corteza está constituida por electrones, mientras que el núcleo lo constituyen protones (partícula de unas 2000 veces mayor que el electrón de carga positiva) y neutrones (de masa semejante a la del protón y sin carga eléctrica).
-NÚMERO ATÓMICO Y NÚMERO MÁSICO:
Se llama número atómico y se signa mediante Z es el número de protones del núcleo de un átomo que siendo neutro coincide con el número de electrones.
Se llama número másico y se designa mediante A al número de protones + el de neutrones de un átomo.
Cuando cambia el número de electrones de un átomo se convierte en un ion que se llama catión si es positivo y anión si es negativo. Si cambia el número de protones se convierte en un átomo de otro elemento.
Si cambia el número de neutrones se convierte en un isótopo, es decir, átomo del mismo elemento pero de diferente masa atómica por tener distinto número de neutrones.
Pléyade es el conjunto de isótopos estables de un elemento; así la pléyade del hidrógeno la constituyen el protio, el deuterio y el tritio de masas atómicas 1, 2 y 3 respectivamente.
Para representar un átomo cualquiera se coloca su símbolo químico. En la inferior izquierda su número atómico Z. En la parte superior izquierda su masa atómica A.

Descubrirlaquimica. Estudiante de química en la USC
28/08/2014