Neutralización ácido base
Uno de los primeros conceptos que se asociaron a los pares ácido-base fue la capacidad de neutralización.
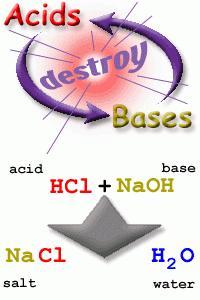
Una neutralización es una reacción que ocurre exclusivamente entre un ácido y una base en la cual las propiedades de ambas sustancias desaparecen en la solución final, la cual se asemeja al agua, siempre y cuando el volumen y concentración del ácido y la base sean equivalentes.
Sin embargo aun cuando una de las dos especies esté en mayor concentración se verá debilitada al ser mezclada con su opuesto.
Una neutralización exitosa es cuando se logra disipar todas las propiedades de ácido o de base, generando una solución semejante al agua con sales.
La reacción general de un par ácido base es la siguiente:
En ausencia de un ácido la base reacciona con el agua capturando protones y dejando libres grupos hidroxilo.

Pero en presencia de un ácido, la base reacciona más fácilmente con los protones de este

Esta reacción nos permite ver precisamente con la reacción ácido base no es otra cosa que la transferencia de protones desde un ácido a una base, bajo la teoría de Bronsted-Lowry.
Generalmente los pares empleados para las prácticas de laboratorio de química básica son hidróxidos para proporcionar la base hidroxilo y ácidos inorgánicos fuertes como el ácido clorhídrico, debido a que los cálculos entre estas sustancias son sencillos y a que el producto resultante no es tóxico, siendo en general agua con iones de cloro I y sodio I como si fuera agua salada.
Un detalle más, los hidróxidos no son bases en sí mismas, por lo que al emplearlos la reacción general cambia.

No es raro que esta expresión genera se escriba de la siguiente forma
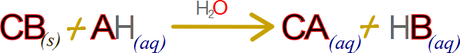
A pesar de lo común contiene una enorme cantidad de errores implícitos. Por ejemplo, debido a que C es generalmente un metal alcalino o alcalinotérreo y B es el grupo hidroxilo, la reacción ácido base en su generalidad tiende a resumirse en la expresión, ACIDO + BASE → SAL + AGUA; haciendo difícil de entender conceptos como el de la base conjugada “que en este caso sería el ion A+”, y el ácido conjugado que sería HB “Si B es el grupo hidroxilo, entonces el ácido conjugado es agua”
Un ejemplo que se empleará de aquí en adelante en esta serie de artículos es el hidróxido de sodio y ácido clorhídrico.
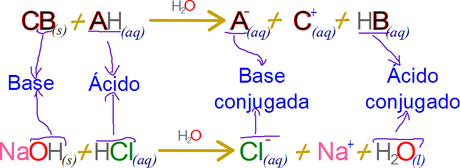
Por último, el hidróxido NO ES una base, el CONTIENE la base hidroxilo, es el hidroxilo quien capta el protón en base a la definición de base de Bronsted y no el hidróxido como un todo molecular. PRINCIPAL REGRESAR
