Los átomos unidos por enlaces covalentes forman moléculas. Una vez que sabemos esto podemos preguntarnos si existe algún tipo de unión entre moléculas vecinas. La respuesta es si: las moléculas, sin estar directamente enlazadas, se unen por atracciones electrostáticas. Este tipo de interacción también es responsable de la unión de los átomos de los gases nobles entre si. La energía de los enlaces intermoleculares suele ser mucho menor que la energía de enlaces interatómicos. Como son enlaces débiles, en vez de llamarlos enlaces intermoleculares les llamaremos fuerzas intermoleculares. Estas fuerzas hacen que los compuestos moleculares tengan puntos de fusión y ebullición más altos de lo esperado, por lo que pueden ser sólidos o líquidos en lugar de ser siempre gases, como sucedería sino existiesen estas fuerzas. Las fuerzas intermoleculares:
Los átomos unidos por enlaces covalentes forman moléculas. Una vez que sabemos esto podemos preguntarnos si existe algún tipo de unión entre moléculas vecinas. La respuesta es si: las moléculas, sin estar directamente enlazadas, se unen por atracciones electrostáticas. Este tipo de interacción también es responsable de la unión de los átomos de los gases nobles entre si. La energía de los enlaces intermoleculares suele ser mucho menor que la energía de enlaces interatómicos. Como son enlaces débiles, en vez de llamarlos enlaces intermoleculares les llamaremos fuerzas intermoleculares. Estas fuerzas hacen que los compuestos moleculares tengan puntos de fusión y ebullición más altos de lo esperado, por lo que pueden ser sólidos o líquidos en lugar de ser siempre gases, como sucedería sino existiesen estas fuerzas. Las fuerzas intermoleculares:- Actúan a distancias muy cortas.
- Son de menor magnitud que las energías de enlace intramoleculares.
- Son responsables de estados de agregación de las especies y de su solubilidad en diferentes disolventes.
 Las cargas en los cationes están más concentradas porque estos iones suelen ser más pequeños que los aniones. En consecuencia, con una carga de igual magnitud, un catión experimenta una interacción más fuerte con los dipolos que un anión. Un ejemplo de este tipo de interacciones intermoleculares es la disolución de especies iónicas en agua.
Las cargas en los cationes están más concentradas porque estos iones suelen ser más pequeños que los aniones. En consecuencia, con una carga de igual magnitud, un catión experimenta una interacción más fuerte con los dipolos que un anión. Un ejemplo de este tipo de interacciones intermoleculares es la disolución de especies iónicas en agua.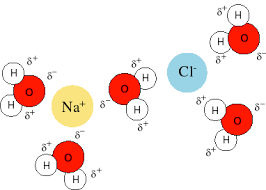
Los sodios con carga positiva hacen que el oxígeno con carga parcial negativa se oriente hacia ellos.
Los cloros con carga negativa hacen que el hidrógeno con carga parcial positiva se oriente hacia ellos.
El agua actuaría como dipolo y los iones cloro y sodio actúan como iones
Interacciones dipolo-dipolo
Un ejemplo de esto es la disolución de solutos polares en disolventes polares.
-FUERZAS INDUCTIVAS:
Si un ión o molécula polar se acerca a un átomo (o una molécula no polar), la distribución electrónica del átomo (o molécula) se distorsiona por la fuerza que ejerce el ión o la molécula polar, dando lugar a una clase de dipolo.
IÓN-DIPOLO INDUCIDO: La presencia de un ión induce un dipolo en una molécula inicialmente apolar.
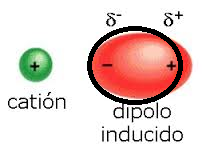
Un ejemplo de este tipo de interacciones es la pequeña solubilidad de especies iónicas en disolventes apolares.
DIPOLO-DIPOLO INDUCIDO: La presencia de un dipolo induce otro dipolo en una molécula inicialmente apolar.

Interacciones dipolo-dipolo inducido
-FUERZAS DE DISPERSIÓN:DIPOLO INSTANTÁNEO - DIPOLO INDUCIDO:FUERZAS DE DISPERSIÓN: FUERZAS DE LONDON: Son las que se dan en compuestos formados por moléculas apolares. Como las nubes electrónicas de las moléculas no son estáticas, sino que los electrones están en continuo movimiento, hay movimientos en los que no coincide el centro de las cargas negativas con el de las cargas positivas y se crean dipolos instantáneos. Estos, a su vez, provocan la formación de dipolos inducidos en las moléculas vecinas, apareciendo fuerzas de atracción entre ellos. Los dipolos instantáneos son siempre nulos en término medio.
La nube electrónica, fácil de deformar aumenta la posibilidad de que se formen dipolos instantáneos. "Estas fuerzas aumentan a medida que aumenta el tamaño de los átomos de las moléculas, que se unen en general, cuanto más elevada sea la masa molecular".
Al aumentar estas fuerzas, aumenta el punto de ebullición de algunas sustancias.
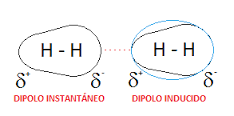

Nitrógeno

Cloro

Oxígeno
Estas fuerzas son dependientes de la polarizabilidad y la masa molecular. Las moléculas apolares con mayor punto de ebullición son aquellas que tienen una mayor masa molecular.-EL ENLACE DE HIDRÓGENO:
Al enlazarse covalentemente un átomo pequeño muy electronegativo (flúor, oxígeno o nitrógeno) con el hidrógeno, este atrae hacia si el par de electrones de enlace, adquiriendo una carga parcial negativa y dejando al hidrógeno con una carga parcial positiva capaz de atraer al átomo negativo de otra molécula.
"Los enlaces de hidrógeno son más fuertes cuanto más electronegativo sea el átomo unido al hidrógeno".
Se puede considerar como un caso particular de interacción fuerzas dipolo-dipolo de mayor intensidad.
En estas moléculas se observa un aumento del valor del punto de ebullición por encima del valor que se esperaría sino existiese este enlace.
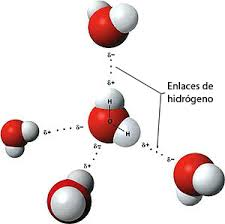
En esta imagen se muestra el enlace de hidrógeno en el agua.
En libros de biología podemos leer la expresión "puentes de hidrógeno"
para referirse al caso concreto del agua. Esta expresión sólo es aplicable
al caso del agua.
En enlace de hidrógeno tiene mucha importancia biológica ya que ayuda a explicar la estructura de muchas proteínas y la estructura helicoidal del DNA.
-FUERZAS INTERMOLECULARES Y PROPIEDADES FÍSICAS DE LAS SUSTANCIAS:
Las fuerzas intermoleculares ayudan a explicar las propiedades físicas de las sustancias, en este ultimo apartado del artículo las explicaré.
SOLUBILIDAD: Cuando una sustancia (soluto) se disuelve, las interacciones que se establecen entre las moléculas de disolvente y las de soluto deben ser iguales o superiores a las interacciones que unen a las moléculas de soluto entre si, de forma que la pérdida de estabilidad que acompaña a la disolución de la sustancia quede compensada con las interacciones con el disolvente. Esta es la causa de que los compuestos se disuelvan en disolventes de polaridad semejante.
- Los compuestos polares se disuelven en disolventes polares: La energía necesaria para romper los enlaces dipolo-dipolo del soluto se obtiene de la formación de otros enlaces dipolo-dipolo entre las moléculas de soluto y las de disolvente.
- Los compuestos apolares se disuelven en disolventes apolares: Las fuerzas de London que unen a las moléculas de soluto se sustituyen por otras semejantes que se establecen entre las moléculas de soluto y las de disolvente. Los compuestos apolares no se disuelven en disolventes polares porque para eso tendrían que romperse los enlaces dipolo-dipolo de las moléculas de disolvente, que son más fuertes que los que se pueden formar.
PUNTOS DE FUSIÓN Y EBULLICIÓN: Están directamente relacionados con la unión entre moléculas, entonces aumentan con ellas.
Si comparamos compuestos con distintos tipos de fuerzas intermoleculares, los puntos de fusión y ebullición aumentan en el orden: Compuestos apolares>Compuestos polares>Compuestos con enlace de hidrógeno.
Si comparamos los puntos de fusión y ebullición entre compuestos con el mismo tipo de fuerzas intermoleculares apreciamos que;
- En compuestos apolares aumentan con la masa molecular.
- En compuestos polares aumentan cuanto mayor sea la masa molecular, ya que las atracciones dipolo-dipolo se ven incrementadas por la formación de dipolos instantáneos.
- En compuestos con enlace de hidrógeno aumentan cuanto más electronegativo sea el átomo unido al hidrógeno y cuanto mayor sea el número de enlaces de hidrógeno que puede formar cada molécula.