 IntroducciónLos pólipos adenomatosos son tumores neoplásicos epiteliales benignos con potencial variable de malignidad. La secuencia adenoma-carcinoma es bien conocida y se acepta que más del 95% de todos los cánceres colorrectales se originan de adenomas. La Organización Mundial de la Salud (OMS) clasifica a los adenomas en: tubular (menos del 20% de arquitectura vellosa), túbulo-velloso y velloso [1], con aproximadamente un 87% de adenomas tubulares, 8% túbulo-vellosos y 5% vellosos. Sólo el 5% de los adenomas están en peligro de volverse malignos. La probabilidad de displasia de alto grado y de transformación carcinomatosa aumenta con el tamaño del pólipo, especialmente cuando son más grandes de 1 cm, tienen un componente velloso, hay muchos pólipos o la edad al momento de hacerse el diagnóstico es de más de 60 años. Se considera que la neoplasia está avanzada cuando los pólipos tienen 1 cm o más de diámetro, hay un componente velloso o una displasia de alto grado. Más del 25% de los pólipos avanzados [2] y los cánceres de colon se localizan en el área proximal al ángulo esplénico [3]. Los pólipos mixtos también tienen la habilidad para volverse malignos, al igual que el síndrome de poliposis hiperplásica.
IntroducciónLos pólipos adenomatosos son tumores neoplásicos epiteliales benignos con potencial variable de malignidad. La secuencia adenoma-carcinoma es bien conocida y se acepta que más del 95% de todos los cánceres colorrectales se originan de adenomas. La Organización Mundial de la Salud (OMS) clasifica a los adenomas en: tubular (menos del 20% de arquitectura vellosa), túbulo-velloso y velloso [1], con aproximadamente un 87% de adenomas tubulares, 8% túbulo-vellosos y 5% vellosos. Sólo el 5% de los adenomas están en peligro de volverse malignos. La probabilidad de displasia de alto grado y de transformación carcinomatosa aumenta con el tamaño del pólipo, especialmente cuando son más grandes de 1 cm, tienen un componente velloso, hay muchos pólipos o la edad al momento de hacerse el diagnóstico es de más de 60 años. Se considera que la neoplasia está avanzada cuando los pólipos tienen 1 cm o más de diámetro, hay un componente velloso o una displasia de alto grado. Más del 25% de los pólipos avanzados [2] y los cánceres de colon se localizan en el área proximal al ángulo esplénico [3]. Los pólipos mixtos también tienen la habilidad para volverse malignos, al igual que el síndrome de poliposis hiperplásica.EpidemiologíaLa prevalencia de pólipos cancerosos en las series de pólipos resecados endoscópicamente es del 0,2% al 11% [4-7]. En la actualidad, el número de casos en que son removidos los pólipos malignos está en aumento a causa de los programas de catastro. En una población asintomática de personas de más de 50 años de edad que fue sometida a colonoscopía directa, hubo una prevalencia del 0,8% de adenocarcinomas, de los cuáles el 50% fueron carcinomas in situ o en estadio I [8,9]. Durante los programas de catastro, los adenocarcinomas han sido detectados entre el 3% y el 4,6% de aquellos que fueron sometidos a endoscopia después de un resultado positivo de la prueba inmunológica para sangre oculta en materia fecal [1,10]. En el año 2006, Rubio y col. [11] reportaron 10 pacientes con síndrome de poliposis coli hiperplásica y una revisión de la literatura mostró que el 50% (74/147) de los pacientes con síndrome de poliposis coli hiperplásica desarrollaron cáncer colorrectal (CCR).HistologíaCarcinoma in situ, carcinoma intramucoso, displasia de alto grado o neoplasia epitelial, es el estadio en el que no hay compromiso de la muscularis mucosae. En general, este estadio tumoral no causa metástasis. Es clasificado como pTis o Estadio 0 en el sistema de estadificación TNM. Esos términos son definidos como neoplasia no invasiva de alto grado (NNAG) en la clasificación de Viena [12]. Carcinoma in situ, o displasia de alto grado, o neoplasia intraepitelial, corresponde a un carcinoma que está restringido al plano epitelial sin invasión de la lámina propia. El carcinoma intramucoso es un carcinoma caracterizado por la invasión de la lámina propia.Cuando el carcinoma se extiende a la submucosa, se considera que el pólipo se ha vuelto maligno, siendo capaz de diseminarse a los ganglios linfáticos o a sitios a distancia. Los tumores que afectan la submucosa son clasificados como T1 y corresponden al Estadio I del sistema de estadificación TNM. Este término es definido como carcinoma submucoso en la clasificación de Viena [12] o pólipo maligno.El término seudoinvasión se refiere a la presencia de epitelio glandular de la mucosa por debajo de la muscularis mucosae en los pólipos colónicos. Estas lesiones no tienen potencial maligno y deberían ser tratadas de manera similar que los adenomas [13]. No obstante, este fenómeno puede ser confundido con un carcinoma invasor por un patólogo inexperto. La seudoinvasión ocurre habitualmente en pólipos grandes (> 1 cm), especialmente en aquellos con pedicuros largos y se la halla más comúnmente en los pólipos del colon sigmoides. Islas de epitelio adenomatoso son desplazadas a través de la muscularis mucosa y son encontradas dentro de la submucosa del pedículo. El tejido glandular desplazado tiene habitualmente bordes redondeados, no infiltrativos, acarreando una pequeña cantidad de lámina propia y es citológicamente idéntico al componente adenomatoso suprayacente. La hemorragia y el depósito de hemosiderina son comúnmente vistos y son una pista para el diagnóstico. Además, puede hallarse inflamación y tejido de granulación. La dilatación quística de las glándulas desplazadas con distensión mucinosa es también no infrecuente en la seudoinvasión, porque la mucina producida por las glándulas atrapadas no tiene forma de alcanzar el lumen. Ocasionalmente, ocurre la rotura de las glándulas dilatadas con extravasación de mucina acelular y hay una respuesta inflamatoria subsiguiente. La distinción con el carcinoma mucinoso (coloide) es importante y puede ser dificultosa. Específicamente, en el carcinoma mucinoso, la acumulación de mucina contiene células malignas, una característica ausente en la seudoinvasión. Por estas razones, es altamente recomendable obtener niveles de sección y segundas opiniones en los casos de pólipos con potencial seudoinvasión [14].Todos los adenomas tienen algún grado de displasia, sea alta o baja. Sin embargo, las displasias de bajo y alto grado son subdivisiones artificiales de un espectro; no hay definición de “alto grado”. Más aún, el libro sobre tumores del aparato digestivo de la OMS, no contiene una lista de criterios para la displasia de alto grado en los adenomas [15,16]. No obstante, en general, la displasia de alto grado comprende cambios más substanciales e incluye al carcinoma in situ. Entre esos cambios se considera a la alteración arquitectónica, a menudo aparentando la disposición glandular de los adenomas y anomalías citológicas, principalmente pleomorfismo celular y nuclear, hipercromatismo nuclear, pérdida de la polaridad nuclear y estratificación marcada del núcleo. Otros autores han considerado como características de la displasia de alto grado: pérdida de la arquitectura glandular normal, células hipercromáticas con núcleos multicapas irregulares y pérdida de mucina, alto cociente nuclear/citoplasmático, atipia nuclear marcada con núcleos prominentes y patrones cribiformes focales. No todas estas características están necesariamente presentes en el mismo grado en todos los epitelios displásicos, mientras que la displasia de bajo grado manifiesta esos mismos cambios pero en una proporción menor [15.16].Factores pronósticos
Muchos factores han sido asociados con una alta probabilidad de enfermedad residual o de carcinoma recidivado.Morfología
La morfología es descrita como subtipos polipoide (pediculado o sésil) y no polipoide (plano o ulcerado), de acuerdo con la clasificación de París [17]. El endoscopista debería estar alerta de algunas características que son sugestivas de posible malignidad. Esas características incluyen tamaño, presencia de ulceración deprimida, bordes irregulares, deformidad, pedículo corto e inmóvil y la imposibilidad de elevar un pólipo sésil cuando se crea una burbuja submucosa. Las neoplasias colorrectales no polipoideas tienen una asociación mayor con el carcinoma (NNAG o carcinomas submucosos invasores), comparas con las neoplasias polipoideas, independientemente del tamaño [7]. Los intentos de diagnóstico en esas lesiones sospechosas, así como en lesiones planas o deprimidas, pueden realizarse usando la cromoendoscopía y técnicas de magnificación, que pueden resaltar las anomalías de la citoarquitectura glandular, mientras que también revelan información relativa a la extensión de la invasión submucosa [18,19]. Kudo y col. [20], desarrollaron la clasificación basada en el patrón de las criptas (pit pattern) para los pólipos de colon con seis clases de patrones de superficie delineados por endoscopía magnificada después de la tinción con índigo-carmín (Tabla 1). Se ha observado que la Clase 5 de esa clasificación o una superficie desestructurada se correlaciona bien con el diagnóstico de malignidad y puede brindar información adicional importante previo al tratamiento endoscópico. No obstante, la ecografía endoscópica utilizando mini-transductores transendoscópicos de alta frecuencia, parece ser el método más seguro para definir la invasión submucosa o a la pared intestinal, permitiendo una derivación directa para la intervención quirúrgica en aquellos casos con infiltración profunda que tienen alto riesgo de diseminación linfática [21].TABLA 1: Clasificación pit pattern
Tipo de lesión Descripción
Tipo 1 Glándulas redondeadas sin deformación
Tipo 2 Aspecto estrellado o papilar
Tipo 3 L Aspecto tubular agrandado o redondeado
Tipo 3 S Aspecto tubular pequeño o redondeado
Tipo 4 Aspecto de ramas deformadas o conjuntos de trabeculado
Tipo 5 Desestructuración completa
Tipo de resecciónCuando se realiza la resección en bloque de un pólipo es posible evaluar la profundidad de la infiltración de las células tumorales y si el margen está afectado. Los pólipos malignos pediculados son fácilmente removidos usando un ansa corrediza. No obstante, esta técnica resulta frecuentemente en una remoción fragmentada cuando se aplica a los pólipos malignos sésiles o planos. Sin embargo, cerca de un tercio de los pólipos malignos son resecados de esta manera [22]. La resección en bloque es ventajosa porque permite una evaluación histológica de toda la pieza y se asocia con una tasa más baja de recidiva, que la resección por fragmentos [23]. Se ha encontrado que la resección submucosa endoscópica (RES) es particularmente útil para la remoción de lesiones adenomatosas sésiles o planas. Tiene como ventaja sobre las otras técnicas endoscópicas, que permite una resección en bloque de lesiones colónicas grandes (> 2 cm). En la RES se usa un dispositivo electroquirúrgico de corte para disecar cuidadosamente las capas más profundas de la submucosa para remover las lesiones neoplásicas en la mucosa. En un meta-análisis se halló que la RES en bloque se logra en el 84.9% de las lesiones y se obtienen márgenes verticales y laterales claros en el 75,3% de los casos [24].Margen de resección de la polipectomía
Es esencial que el patólogo identifique el pedículo o la profundidad de la quemadura por diatermia. El riesgo de recidiva va del 0% al 2% en los pólipos malignos con un margen de resección mayor de 1 mm. Cuando el margen de resección está también comprometido, o es menor de 1 mm, el porcentaje de recidiva oscila entre el 21% y el 33% [25]. La mayoría de los autores cree que un margen de resección > 2 mm es seguro y que en esos casos la probabilidad de enfermedad residual o carcinoma recidivado es baja [4,5,25,26]. Sin embargo, aún está en debate si el requisito de la distancia entre el cáncer y el margen de resección debería ser >1, >2 ó >3 mm o sólo un margen claro de resección.Estadio de diferenciación
Se consideraron cuatro grados. El Grado 1 correspondió al adenocarcinoma bien diferenciado de tipo intestinal y está compuesto por glándulas bien formadas con lumen abierto o con más del 95% de diferenciación glandular. El Grado 2 fue el adenocarcinoma de tipo intestinal moderadamente diferenciado, conteniendo nidos sólidos mostrando sólo glándulas focales o con una diferenciación glandular de 50%-95%. En el caso del Grado 3, el carcinoma es de tipo intestinal, pobremente diferenciado, células en anillo de sello o adenocarcinoma mucinoso, compuesto por células hipercromáticas dispuestas en láminas sólidas y formando glándulas absortivas; estos tumores tienen una diferenciación glandular entre el 5% y el 50%. Los tumores indiferenciados, que tienen menos del 5% de diferenciación glandular, corresponden al Grado 4. Los carcinomas medulares con alta inestabilidad microsatelital son clasificados como carcinomas indiferenciados. El pronóstico se correlaciona con el grado histológico [27]. El Grado 3 de diferenciación es visto en el 5,7% al 9,2% de los pacientes con pólipos y el riesgo de lesiones residuales o de recidiva en estos casos está en el orden del 36%-38% [25]. En la mayoría de los casos, la diferenciación de Grado 3 se asocia con células invasoras de adenocarcinoma < 1 mm desde el borde claramente visualizado.Nivel de invasión del adenocarcinoma dentro del pólipo
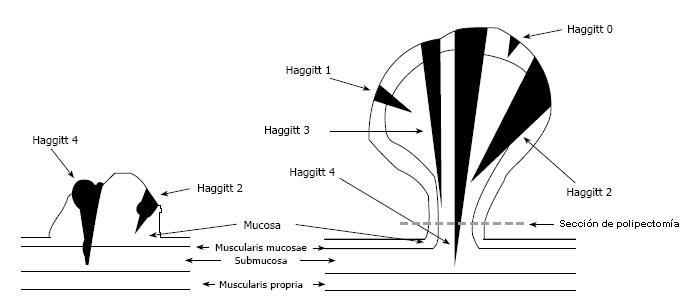
Haggitt y col. [28] asignaron regiones anatómicas (niveles) de invasión para cada pólipo maligno. En este estudio el Nivel 1 describe el adenocarcinoma invasivo limitado a la cabeza del pólipo; el Nivel 2 incluye el compromiso del cuello; el Nivel 3 corresponde a células de adenocarcinoma en el pedículo y el Nivel 4 de invasión de las células del adenocarcinoma infiltrando la submucosa a nivel de la pared intestinal adyacente (Figura 1). En este sistema, el adenocarcinoma invasor en un pólipo sésil tiene, por definición, un Nivel 4 de invasión. No obstante, la evaluación histológica precisa del nivel de Haggitt puede ser difícil, especialmente la diferenciación entre Nivel 1 vs 2, y 2 vs 3. La marcación y orientación adecuada de las piezas son esenciales. Algunos autores concluyen en que sólo los pacientes con Nivel 4 de invasión requieren resección [29]. Más recientemente, algunos autores han propuesto un sistema de clasificación histológica adicional basado en el grado de diferenciación celular en los bordes de la lesión y en el tamaño y profundidad de la invasión de la submucosa. Consecuentemente, el grado de invasión submucosa ha sido clasificado en tres tipos, basado en la profundidad de la invasión. Cuando está invadido menos de un tercio de la submucosa el estadio es sm1 y si más de los dos tercios están invadidos, el estadio es sm3, mientras que el estadio sm2 es intermedio, con invasión en el tercio medio. Sm1 es cuando la profundidad de la invasión es < 1mm ó 1.000 µm desde la muscularis mucosae [17]. Se ha demostrado que la penetración de las células cancerosas en el tercio inferior de la submucosa (sm3) de las lesiones sésiles, está asociada con un riesgo más grande de diseminación linfática, que cuando hay sólo una penetración leve [27-32]. La investigación basada en series grandes de pacientes ha mostrado un 1%-3% de riesgo para metástasis en los ganglios linfáticos en los cánceres sm1, 8% en los cánceres sm2 y 23% en los cánceres sm3 [31].
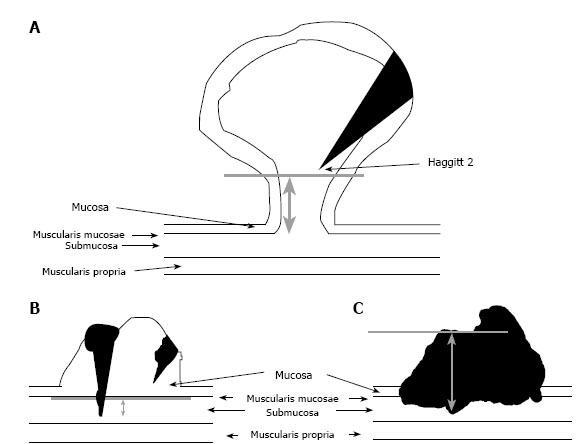
La presencia o ausencia de invasión linfática por el cáncer, es definida como células tumorales con un canal endotelial verdadero en ausencia de glóbulos rojos [34]. El riesgo de diseminación linfática desde un pólipo maligno ha sido estimado por un estudio histológico de las piezas resecadas. Dado que los linfáticos no penetran mucho más allá de la muscularis mucosae, el cáncer focal que no ha invadido a través de ese plano, parece presentar poco o ningún riesgo de diseminación a los ganglios linfáticos [35]. Un plexo de canales linfáticos es hallado normalmente en la submucosa superficial y en la muscularis mucosae, con raras extensiones dentro de la lámina propia (mucosa) limitadas a la región en la base de las criptas. La cercana ausencia de linfáticos en la mucosa ha sido propuesta como la razón para la ausencia observada de potencial maligno (metástasis ganglionar linfática) comprobada en los pólipos que muestran un carcinoma sólo intramucoso. Sin embargo, esta teoría ha sido desafiada por estudios que emplearon técnicas más sensibles para detectar los vasos linfáticos. Los estudios utilizando el relativamente nuevo anticuerpo D2-40 (Dako, Carpenteria, CA, USA), que tiñe el endotelio linfático pero no el de los vasos sanguíneos, ha demostrado que los linfáticos son sometidos a proliferación y están presentes en el tallo y mucosa de los adenomas y en los cánceres tempranamente invasivos. En los pólipos malignos, los canales linfáticos están frecuentemente presentes en la cercanía de los nidos de tumores infiltrantes [36,37]. Desde un punto de vista práctico, la detección de invasión linfática por patólogos expertos utilizando un microscopio óptico, es difícil. No hay guías reconocidas para establecer la presencia de invasión linfática (por ejemplo, el número de secciones o inmunotinciones necesario para identificar los vasos linfáticos).
Por ejemplo, en un estudio en el que cinco patólogos investigaron la invasión linfática de 140 pólipos malignos, concordaron (4 de 5 observadores) en sólo 17 casos. La variabilidad intra e inter observador en la interpretación de las muestras, aceptada aún entre los histopatólogos más expertos, puede ser alta y, a menudo, conduce a incertidumbre diagnóstica que inevitablemente resulta en que se tome un abordaje terapéutico más precavido [38]. La verdadera invasión linfática es rara, aunque es común que la retracción del tejido cree un espacio artificial alrededor de las células tumorales en las secciones de parafina. El uso de inmunohistoquímica (D2-40) puede ayudar a identificar los canales linfáticos. Sin embargo, su uso no es aún rutinario y las cuestiones técnicas, como la pérdida de un foco sospechoso en los niveles de sección, limita la efectividad de las tinciones especiales en este escenario. La presencia de invasión linfática en un pólipo maligno ha sido propuesta por algunos investigadores como una indicación para la colectomía. No obstante, se han reportado pocos pólipos con invasión linfática y la mayoría de ellos han tenido márgenes positivos, adenocarcinoma invasor de Grado 3 (como ya fuera definido) o ambos [5]. Aproximadamente del 12% al 16% de todos los pólipos tienen invasión linfática y, en esos casos, el riesgo de recidiva o de lesiones residuales va del 17% al 39%.Invasión vascular
La presencia o ausencia de invasión venosa es definida como un cáncer en un canal endotelial rodeado por una pared de músculo liso [36]. No obstante, es difícil reconocer la invasión venosa. Los marcadores vasculares, tales como CD31, CD34 y Factor VIII pueden ayudar en la investigación de la invasión vascular. Esos marcadores tiñen fuertemente el endotelio de los vasos sanguíneos y, en menor extensión, el endotelio linfático [14]. La prevalencia de la invasión venosa en los pólipos malignos varía mucho de un estudio a otro, yendo desde un 3,5% a un 39% [38]. La invasión venosa frecuentemente se asocia con la invasión linfática y/o con tumores con un margen de resección de menos de 2 mm y/o pobremente diferenciados. En contraste con la mayoría de los estudios, Talbot y col. [39] observaron que la invasión venosa no se asoció con un peor pronóstico.Histología favorable y desfavorable y el riesgo de enfermedad residual o carcinoma recidivado
La histología favorable es definida como adenocarcinoma con Grado 1 o 2 de diferenciación en el que las células carcinomatosas están, al menos, a 2 mm de un margen claramente visualizado, la resección es realizada en bloque y existe ausencia de invasión vascular o linfática.La definición de histología desfavorable es cuando la distancia entre el tumor invasor y el borde cauterizado de la biopsia es < 2 mm o 2.000 µm, hay una resección fragmentada o tumor en la región cauterizada constituyendo un borde positivo, o un tumor pobremente diferenciado (Grado 3), o hay invasión linfática o vascular. En estos casos, está indicada la resección quirúrgica a causa de un riesgo aumentado de metástasis ganglionar linfática o enfermedad residual [14]. Por el otro lado, en ausencia de características desfavorables, la polipectomía es considerada curativa. Las piezas que no se prestan para un análisis adecuado por cualquier razón (remoción fragmentada o pobre orientación) resultan a veces en una decisión, por defecto, de resección.En 1995, Vork y col. [5], revisaron 20 estudios en los que se analizaban 858 pólipos malignos. Observaron que en 89 pacientes (10%) hubo enfermedad residual o carcinoma recurrente. Sin embargo, hubo recidivas o tumores en el área de resección en sólo 8 pacientes (1%) con criterios histológicos favorables. Estudios subsiguientes también han reportado una incidencia de menos del 1% [38,40]. Sólo un estudio describió una incidencia más alta del 5% en pólipos malignos con histología favorable [41] y fue ampliamente criticado y excluido de revisiones subsiguientes [5]. En contraste, en los pólipos malignos con histología desfavorable, el riesgo de recidiva o lesiones residuales oscila entre el 10% y el 39% [5,14,31,40].Tratamiento
Previo a la remoción del pólipo, es difícil saber si es maligno o no. Algunas características, que ya han sido mencionadas, pueden dar alguna indicación sobre el grado de malignidad (Figura 3). En esos casos, es aconsejable efectuar un tatuaje para marcar la base del pólipo resecado. A pesar de las características morfológicas, un pólipo normalmente es resecado cuando se lo detecta. La polipectomía debería ser realizada en bloque, dado que es esencial establecer y definir los criterios histológicos favorables y desfavorables. En unos pocos casos se efectúa solamente la biopsia de los pólipos. Esto puede deberse a la falta de coagulación, a la dificultad para resecarlo en un tiempo adecuado o en un paciente anticoagulado o medicado con drogas antiplaquetarias.Las NNAG, más allá de su morfología, son consideradas como curadas con la polipectomía [42].
La indicación para un pólipo maligno con morfología sésil, a pesar de tener criterios histológicos favorables, es la cirugía [1], especialmente en pacientes menores de 50 años, que tienden a presentar pocas complicaciones quirúrgicas [39]. La RES ha emergido como una técnica factible para resecar exitosamente los pólipos colónicos malignos en bloque [24,43]. Este abordaje está indicado para los pólipos mayores de 2-3 cm, comprometiendo más de un tercio de la circunferencia del colon o dos pliegues haustrales o con una morfología plana/deprimida. La técnica hace posible tratar pólipos grandes (> 2 cm) sésiles y planos, permitiendo la evaluación anatomopatológica y la curación en la mayoría de los pacientes. La RES es mejor que la resección mucosa endoscópica convencional porque tiene tasas más altas de resección en bloque y de curación, a pesar de ser un procedimiento de mayor duración y con más perforaciones asociadas [44]. Además, la RES puede ser una alternativa a la cirugía para los pacientes añosos y para aquellos que presentan condiciones asociadas que contraindican la cirugía. Asimismo, este tipo de resección debería ser considerado para los pólipos malignos con morfología sésil y, por lo tanto, con indicación quirúrgica, a pesar de los criterios histológicos.El tratamiento quirúrgico está recomendado también para los pólipos malignos con morfología pediculada que tienen criterios histológicos desfavorables (resección parcial del pólipo, carcinoma pobremente diferenciado, invasión linfática o vascular, margen de resección < 2 mm o profundidad de la invasión submucosa > 3 mm de la muscularis mucosae) [1,33]. Por otro lado, para los pólipos malignos con morfología pediculada pero con criterios histológicos favorables, la polipectomía es considerada curativa.Sin embargo, hasta ahora, muchos reportes anatomopatológicos no mencionan los criterios histológicos. Por ejemplo, en la Universidad de Minnesota entre 1987 y 2000, en el 83% de los pacientes no se reportó la invasión vascular angiolinfática, en el 69% la profundidad de la invasión por las células cancerosas no fue reportada y en el 22% no se estableció el grado de diferenciación [45]. Además, la concordancia entre los patólogos experimentados fue pobre en relación con el grado histológico de diferenciación del carcinoma y la invasión a los vasos angiolinfáticos [45].En los últimos años se han identificado varios marcadores séricos en un esfuerzo para establecer qué pacientes podrían beneficiarse con el tratamiento quirúrgico y con un estricto seguimiento. Esos marcadores incluyen la metaloproteinasa 7 [46], las proteínas de adhesión vascular [47], los factores de crecimiento endotelial vascular [48] y las citoqueratinas [49]. La mayoría de los marcadores han sido estudiados en pacientes operados por cáncer de colon con infiltración de la muscular propia (equivalente o superior a T2), por lo que los resultados no pueden ser extrapolados fácilmente a los pólipos colorrectales malignos.Una excepción a esas guías son los pacientes con pólipos malignos, con morfología sésil o plana, que están localizados en el recto. La ocurrencia de metástasis a distancia se correlaciona con el estadio T y, después de la resección radical del tumores T1, la tasa de metástasis es de alrededor del 10% [50], similar a la de los pólipos malignos en otras localizaciones. Una evaluación preoperatoria adecuada del estado general de salud de los pacientes es esencial, antes de decidir la modalidad de tratamiento para el paciente individual con cáncer de recto T1. Cerca del 50% de las recidivas locales que siguen a las resecciones locales son curables si los pacientes son incluidos en un programa de seguimiento intensivo. El cáncer rectal T1 debería ser clasificado en, al menos, dos subgrupos (bajo y alto riesgo). Los criterios más ampliamente aceptados para clasificar a los cánceres T1 como de bajo riesgo son un diámetro tumoral < 3 cm o infiltración tumoral no más profunda que la capa media de la submucosa. Algunos autores difieren en si los cánceres T1 sm2 deberían ser clasificados como cánceres de bajo o alto riesgo. Entre los criterios de bajo riesgo están el diámetro tumoral < 3 cm, diferenciación alta o intermedia, infiltración no más profunda que la capa media de la submucosa (sm1 o sm2) y ausencia de signos de infiltración linfovascular [51]. Los cánceres T1 de bajo riesgo deberían ser tratados con resección local (RES o resección submucosa endoscópica convencional o microcirugía endoscópica transanal). También, la resección local de los cánceres T1 de alto riesgo puede ofrecer el mejor tratamiento para los pacientes más ancianos (> 80 años) y para aquellos con comorbilidad [51].La microcirugía endoscópica transanal (MET) es una técnica quirúrgica mínimamente invasiva que permite al cirujano operar sobre alteraciones en el recto medio y alto sin tener que hacer una incisión a través del abdomen. La MET es una técnica segura con pocas complicaciones. La tasa de recidiva local varía ampliamente, menos del 10% en pacientes con bajo riesgo. El paciente ideal para la resección local con MET, por lo tanto, tiene un cáncer T1 pequeño con bajo riesgo, localizado entre los 5 y 10 cm del margen anal (5-15 cm sobre la pared rectal posterior) [51].Seguimiento
En los casos de NNAG y pólipos malignos con morfología pediculada y criterios histológicos favorables, se recomienda realizar una colonoscopía 3 meses después de tomada la biopsia [1,52]. Si esta es normal, es aconsejable un control adicional después de un año, tres años y cinco años [48]. Algunos autores sugieren que si los resultados a los 3 meses son negativos, el monitoreo subsiguiente debería ser el mismo que el de los pacientes con adenomas no malignos, dado que no hay evidencia de que esos pacientes tengan un riesgo mayor de pólipos metacrónicos o cánceres, que aquellos pacientes con adenomas benignos [42,53]. No obstante, estudios recientes estiman que el 11,8% de los pacientes que han sido sometidos a polipectomía desarrollarán un adenoma metacrónico avanzado y el 0,6% un carcinoma invasor. Los factores de riesgo asociados incluyen la edad, número de pólipos (5 ó más), tamaño (mayor de 1 cm), arquitectura vellosa, localización proximal y sexo masculino. La odds ratio aumenta progresivamente con el número de adenomas, siendo de 1,39 para aquellos que han tenido 2 adenomas y de 3,87 para aquellos que han tenido 5 ó más. No se encontró que el tabaquismo, índice de masa corporal, antecedentes familiares de CCR y grado de displasia estuvieran asociados con riesgos mayores de adenoma avanzado o cáncer [54].
Han habido reportes de casos de pólipos pediculados malignos con criterios histológicos desfavorables que, a pesar de no haberse hallado carcinoma residual en la pared del intestino o compromiso de los ganglios linfáticos, presentaron en el seguimiento alejado metástasis a distancia, aún cinco años después de la cirugía [4,5]. Estos datos fuerzan a considerar el monitoreo de esos pacientes usando los niveles séricos del antígeno carcinoembrionario y técnicas por imágenes, como la tomografía computada, que podrían permitir la detección temprana de la recidiva.La series publicadas de pólipos colorrectales malignos usualmente incluyen menos de 100 casos y la mayoría de ellas son estudios retrospectivos. En consecuencia, podría ser interesante que se llevaran a cabo nuevos estudios prospectivos, para evaluar el progreso de esos pacientes y establecer el tratamiento y los regímenes de seguimiento más adecuados para ellos.ConclusiónLa prevalencia de pólipos malignos en series de pólipos removidos endoscópicamente es de entre el 0,2% y el 11%. Actualmente, el número de casos en los que se han removido pólipos malignos está en aumento, debido a los programas de catastro. El carcinoma in situ, carcinoma intramucoso, displasia de alto grado o carcinoma intraepitelial, es el estadio en el que no hay compromiso de la muscularis mucosae. Estos términos son definidos como neoplasia no invasiva de alto grado en la clasificación de Viena. Cuando el carcinoma se disemina a la submucosa, se considera que el pólipo se ha vuelto maligno, siendo capaz de diseminarse a los ganglios linfáticos o sitios a distancia. Este término es definido como carcinoma submucoso en la clasificación de Viena. La definición de histología desfavorable es cuando la distancia entre el tumor invasor y el margen cauterizado de la biopsia es < 2 mm, hubo una remoción fragmentada o tumor dentro de la región cauterizada constituyendo un margen positivo, o un tumor pobremente diferenciado (Grado 3), o hay invasión linfática o vascular. En esos casos, la resección quirúrgica está indicada debido al riesgo aumentado de metástasis en los ganglios linfáticos o enfermedad residual. Además, la indicación para un pólipo maligno con morfología sésil, a pesar de los criterios histológicos favorables, es la cirugía. En casos de neoplasia no invasora de alto grado y carcinoma submucoso con morfología pediculada y criterios histológicos favorables, se recomienda que se realice una colonoscopía tres meses después de la toma de la biopsia y, si es normal, se aconseja un control adicional después del año, 3 y 5 años
Dres. Bujanda L, Cosme A, Gil I, Arenas-Mirave JI
World J Gastroenterol 2010; 16(25): 3101-3111
