¿Te suenan las palabras “pool o concentrado de plaquetas” o “unidad de plasma”? Igual no los conoces, pero puede que hayas visto alguna vez a un paciente en el hospital con una bolsa de color ambarino, parecida a los concentrados de hematíes que vimos en el post de la semana pasada. Éstos concentrados estaban compuestos de hematíes, o comúnmente llamados glóbulos rojos, que eran un tipo de las células sanguíneas de las que hablamos en el post de conceptos básicos sobre sangre y hemoderivados. Además, recordemos que no a todo el mundo le sirve la sangre o los hemoderivados de un mismo donante, ya que el ser humano tiene en su sangre unas características antigénicas únicas codificadas como Sistema AB0, además de un factor Rh.
Hoy veremos qué son y para qué sirven los productos plaquetarios (compuestos principalmente por plaquetas) así como aquellos derivados del plasma que contienen células sanguíneas (no confundir con los productos plasmáticos que están basados en proteínas e inmunoglobulinas, éstos los veremos más adelante en otros post).
Repasando los productos hemoderivados
Antes de introducirnos más en materia, vamos a repasar con unos diagramas las partes más importantes de los anteriores post para así poder entender mejor.
Si hacemos memoria, de las donaciones altruistas de sangre se obtenían las unidades de sangre total que, o bien podían ser empleadas directamente, o podían dividirse y extraer subproductos. Estos se clasificaban en componentes sanguíneos y derivados del plasma.
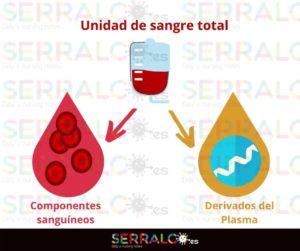
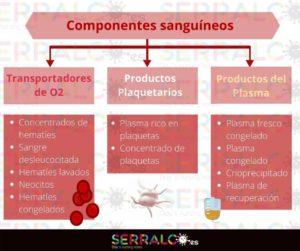
Los componentes sanguíneos, a su vez, pueden dividirse en tres grupos:
- Transportadores de O2
- Productos plaquetarios
- Productos del plasma
Los transportadores de oxígeno los vimos en el post anterior, pero en resumen correspondían a los concentrados de hematíes, la sangre desleucocitada, los hematíes lavados, neocitos y hematíes congelados.
Continuemos, pues aprendiendo sobre los productos plaquetarios y aquellos que derivan del plasma sanguíneo.
Productos plaquetarios
Los productos plaquetarios, como su propio nombre indica, son productos concentrados de plaquetas.
Las plaquetas son fragmentos de células producidas en la médula ósea que reciben el nombre de megacariocitos. Tienen un papel fundamental en el proceso de hemostasia, es decir, ayudan a producir coágulos sanguíneos para hacer más lento el sangrado o frenarlo y también facilitan la cicatrización de las heridas. Cuando se produce un déficit en su cómputo global el riesgo de hemorragia es elevado, y para solucionarlo se pueden administrar de manera externa estos productos:
Plasma rico en Plaquetas (PRP)
Se obtiene tras centrifugar suavemente la unidad de sangre total.
Concentrado o Pool de plaquetas (CP)
Si se centrifuga de nuevo el plasma rico en plaquetas se obtiene un concentrado plaquetario, eliminando la parte más fluida de la solución. También es posible su obtención de donaciones sanguíneas a partir de un proceso llamado aféresis. La aféresis de plaquetas es una técnica mediante la cual se separan los componentes sanguíneos, siendo seleccionados los necesarios en cada momento, en este caso serían las plaquetas, y el resto de componentes se devuelven al torrente sanguíneo del donante.
Normalmente un pool suele contener una mezcla de plaquetas de varias unidades de sangre total. En cifras, cada pool equivaldría a unas 6,7 unidades de plaquetas. Puede durar una media de 6 a 7 días.
Su uso estaría indicado en:
- Pacientes trombocitopénicos que presenten hemorragia.
- Trastornos cualitativos plaquetares con presencia de hemorragia o datos sugerentes de pérdida sanguínea con riesgo vital, o que se vayan a someter a una cirugía.
- Trombocitopenia secundaria a quimioterapia cuando las cifras de plaquetas así lo requieran.
- Cirugías o procesos invasivos en pacientes con niveles plaquetarios bajos.
Plaquetas leucodeplecionadas
Concentrado de plaquetas al que se le han retirado los leucocitos mediante filtración, que está suspendido en plasma o una mezcla de plasma (30-40%) y una solución aditiva (60-70%) y que contiene una dosis de plaquetas terapéuticamente efectiva.
Existen también los componentes plaquetarios leucodeplecionados a los que, además de quitar la serie blanca, se someten a procesos de reducción de patógenos, especialmente pensados para pacientes con procesos críticos de inmunosupresión (oncológicos, receptores de órganos, etc.).
Plaquetas criopreservadas
Concentrado de plaquetas que se somete a congelación tras añadir un agente crioprotector para aumentar su vida útil de una semana a 12 – 24 meses (en función del tipo de criopreservación). La temperatura de conservación no debe superar los -80°C.
Tras terminar de analizar los productos plaquetarios, vamos a continuar aprendiendo sobre los componentes sanguíneos derivados del plasma.
Productos derivados del plasma
Cuando hablamos de Plasma, nos estamos refiriendo a la solución de color ambarino que contiene no solo a las células sanguíneas, sino también proteínas plasmáticas, factores hemostásicos, fibrinógeno, sales, nutrientes, etc.
De esta solución, cuando se encuentra pobre en plaquetas tras ser sometido a diversos procesos de obtención de la unidad de sangre total, podemos obtener los siguientes productos:
Plasma fresco congelado (PFC)
Es el componente sanguíneo obtenido a partir de una unidad de sangre total o mediante aféresis, tras la separación de los hematíes, y puede ser destinado para transfusión o fraccionamiento industrial. Si se obtiene de una unidad de sangre debe ser preparado dentro de las 6 horas posteriores a la extracción.
Tras su separación (u obtención mediante aféresis), debe ser congelado tan pronto como sea posible y a una temperatura que mantenga adecuadamente los factores lábiles de coagulación (T° inferiores a -18°C). Puede ser sometido a reducción de patógenos mediante un proceso validado. Al no contener elementos celulares, puede conservarse durante 12 meses en bolsas de 200 a 250ml a -30°C.
Controversia en el uso del PFC
Para alcanzar niveles hemostásicos de factores de la coagulación disminuidos, habitualmente hay que emplear grandes volúmenes de PFC, ya que ninguno de los factores está concentrado. Esto supone un riesgo de sobrecarga circulatoria muy grave, convirtiéndose así en el factor limitante más importante para el PFC en reemplazo hemostásico. Para resolver este problema, se han creado concentrados de factores específicos de coagulación, que veremos más adelante en un nuevo post.
Indicaciones del PFC
Por tanto, las indicaciones en el uso del PFC, de acuerdo con la Conferencia Consenso sobre el Plasma, son:
- Púrpura trombótica trombocitopénica.
- Púrpura fulminante del recién nacido (RN), secundaria a déficit congénito de proteínas C o S, si no se dispone de concentrados específicos de dichos factores.
- Exanguinotransfusión en neonatos, para reconstituir un concentrado de hematíes si no se dispone de sangre total.
- Transfusión masiva en hemorragia grave (volumen igual o superior a la volemia corporal en menos de 24h).
- Trasplante hepático con sospecha de hemorragia grave o alteración de la coagulación.
- Reposición de factores de coagulación en hemorragia grave o ante una eventualidad de una actuación agresiva (cirugía (Qx), biopsia, extracción dental…) si no se dispone de los concentrados específicos. También si los factores han sido depleccionados durante el recambio plasmático, en el caso de que se haya empleado albúmina como solución de recambio.
- Déficit de vitamina K refractaria a administración IV de la misma, o que no permiten esperar respuesta dada la situación de urgencia.
- Neutralización inmediata de los anticoagulantes orales (ACO) en casos de urgencia (como en pacientes que vayan a ser sometidos a una cirugía inminente o que presentan una hemorragia aguda moderada a grave).
- Rescate de ttos trombolíticos en los que persista el sangrado tras suspender la perfusión trombolítica y administrar inhibidores de la fibrinolisis.
- Coagulación Intravascular Diseminada (CID) aguda, una vez instaurado el tto adecuado.
- Qx cardíacas con circulación extracorpórea en los que se hayan descartado otros motivos de hemorragia.
- Insuficiencia hepatocelular grave y hemorragia microvascular difusa o hemorragia localizada con riesgo vital para el paciente.
Contraindicaciones del PFC
Aunque existe controversia en algunas indicaciones sobre su efectividad que no vamos a mencionar por no alargarnos, si se estipulan una serie de casos en los que el uso del PFC no estaría indicado:
- Reposición de volemia.
- Reposición de factores de coagulación en el recambio plasmático salvo los que se mencionan en los casos de la sección anterior.
- Prevención de hemorragia intraventricular del RN prematuro.
- Aporte de Inmunoglobulinas.
- Profilaxis Qx en pacientes con hepatopatía crónica y alteración en las pruebas de coagulación.
- En hepatopatía crónica e insuficiencia hepatocelular avanzada en fase terminal.
- Corrección del efecto anticoagulante de la heparina.
- Aporte nutricional o en alimentación parenteral.
- Corrección de la hipoproteinemia.
- Ajuste del Hto en los concentrados de hematíes durante las transfusiones a RN
No es una opción aconsejable tampoco en situaciones que puedan resolverse mediante terapias alternativas o coadyuvantes.
Plasma congelado (PC)
Es el plasma separado de la sangre total dentro de las 12 horas posteriores a la extracción, y que es sometido a congelación. Contiene un mínimo del 50% de los factores VIII y V iniciales, por lo que puede ser ideal para tratar déficits de factores de coagulación leve a moderado. Su conservación alcanza los 12 meses a temperaturas de -30°C.
Crioprecipitado
Si se congela el PFC durante las 6h siguientes a su extracción y a temperaturas de -60°C, y después se deja descongelar a 3°C se obtiene un precipitado. Ese precipitado esta compuesto de una parte o fracción de proteínas plasmáticas que permanecen insolubles, y es lo que se denomina crioprecipitado. Estas proteínas plasmáticas contienen los factores VIII, XIII y Von Willebran, así como fibrinógeno y fibronectina.
Tras descongelarse, la mezcla del plasma y crioprecipitado se centrifuga para sedimentar este último, separándose a continuación todo el plasma sobrante, salvo unos 5-10ml. Es necesario que el crioprecipitado contenga un mínimo aproximado de 80 unidades de factor VIII y 250mg de fibrinógeno. Puede conservarse unos 12 meses a -40°C.
Estaría indicado en la enfermedad de Von Willebran y en hipofibrinogenemia, ya que restaura el factor VIII y el fibrinógeno, aportando menor volumen que si administrásemos PFC. Otras indicaciones serían en hemofilia A (déficit congénito factor VIII) y en el déficit congénito del factor XIII, a falta de concentrados de factores específicos.
Plasma de recuperación
Es el plasma separado de la sangre total después que ésta ha sido conservada a 4°C durante 24h. Contiene niveles bajos de factores V y VIII de coagulación. También se puede obtener del sobrante de crioprecipitado, y en ese caso también tendrá niveles bajos de fibrinógeno.
Sus indicaciones se reducen a pacientes que requieren un aumento de volemia o de proteínas plasmáticas sin que se les aporte factores de la coagulación.
Y hasta aquí hemos visto todo lo referente a componentes sanguíneos. En las próximas semanas quiero desarrollar los derivados del plasma, para aprender sobre concentrados de coagulación, agentes oncóticos e inmunoglobulinas. También estoy trabajando en el post sobre sangre artificial y en otro específico de donaciones…
Si creéis que hay algo interesante en los hemoderivados que haya pasado por alto, por favor dejadlo en comentarios para poder ampliar más esta saga.
Bibliografía:
- Arribas Cachá, A. A; Borrego de la Osa, R; Morente Parra, M. Guía de intervención enfermera: fluidoterapia intravenosa. FUDEN 2006. págs: 115 – 122.
- Cortés Fadrique, C.; Del Trigo Méndez, P.; Veiga Frá, R.; Sánchez Bermejo, R.; Rincón Fraile, B.; Fernández Centeno, E. En torno a los hemoderivados. Rev. Enf. Glob. 2015, 37: 23-37. Consultado el día 19/11/2020. Disponible en: http://scielo.isciii.es/pdf/eg/v14n37/clinica2.pdf
- García Gala, J. M.; Bosch Llobet, A.; García Ruiz, A.; Sánchez Salinas, A.; Millán Álvarez, A.; Aguado Bueno, B. et al. Estándares en hemoterapia. FUNDACIÓN PARA LA CALIDAD EN TRANSFUSIÓN SANGUÍNEA, TERAPIA CELULAR Y TISULAR (FCAT). 5ª Ed. 2019. 65-74. Consultado el día 19/11/2020.

