El sistema renina-angiotensina-aldosterona (RAAS) es una elegante cascada de péptidos vasoactivos que orquesta procesos clave en la fisiología humana. El Síndrome Respiratorio Agudo Severo por coronavirus 1 (SARS-CoV-1) y SARS-CoV-2, que han sido responsables de la epidemia de SARS en 2002 a 2004 y de la más reciente pandemia de la enfermedad por coronavirus 2019 (Covid-19), respectivamente se relacionan con el RAAS a través de la enzima convertidora de angiotensina 2 (ACE2), una enzima que contrarresta fisiológicamente la activación del RAAS pero también funciona como un receptor para ambos virus del SARS1,2.
La interacción entre los virus del SARS y ACE2 se ha propuesto como un factor potencial en su infectividad, 3,4 y existen preocupaciones sobre el uso de inhibidores de RAAS que pueden alterar ACE2 y si la variación en la expresión de ACE2 puede ser en parte responsable de la virulencia de la enfermedad en la pandemia de Covid-19 en curso.5-8
De hecho, algunas fuentes de medios y los sistemas de salud han pedido recientemente la suspensión de los inhibidores de la ECA y los bloqueadores de los receptores de angiotensina (BRA), tanto profilácticamente como en el contexto de la sospecha de Covid-19.
Dado el uso común de los inhibidores de la ECA y los BRA en todo el mundo, se necesita con urgencia orientación sobre el uso de estos medicamentos en pacientes con Covid-19.Aquí, destacamos que los datos en humanos son demasiado limitados para respaldar o refutar estas hipótesis y preocupaciones. Específicamente, discutimos los efectos inciertos de los bloqueadores RAAS sobre los niveles y la actividad de ACE2 en humanos, y proponemos una hipótesis alternativa de que ACE2 puede ser beneficioso en lugar de perjudicial en pacientes con lesión pulmonar. También expresamos explícitamente la preocupación de que la retirada de los inhibidores de RAAS puede ser perjudicial en ciertos pacientes de alto riesgo con Covid-19 conocido o sospechado.
Covid-19 y adultos mayores con afecciones coexistentes Los informes iniciales5-8 han llamado la atención sobre la posible sobrerrepresentación de la hipertensión arterial entre pacientes con Covid-19. En la más grande de varias series de casos de China que se han publicado durante la pandemia de Covid-19, la hipertensión fue la afección coexistente más frecuente en 1099 pacientes, con una prevalencia estimada del 15% 9; sin embargo, esta estimación parece ser menor que la prevalencia estimada de hipertensión observada con otras infecciones virales10 y en la población general en China.11,12
Se ha informado que las condiciones coexistentes, incluida la hipertensión, son más comunes entre los pacientes con Covid-19 que han tenido una enfermedad grave, ingresaron en la unidad de cuidados intensivos, recibieron ventilación mecánica o murieron que entre los pacientes que tuvieron una enfermedad leve. Existe la preocupación de que el tratamiento médico de estas afecciones coexistentes, incluido el uso de inhibidores de RAAS, pueda haber contribuido a los resultados adversos de salud observados.
Sin embargo, estas condiciones parecen seguir de cerca con el avance de la edad, 13 que se está convirtiendo en el predictor más fuerte de muerte relacionada con Covid-19.14 Desafortunadamente, los informes hasta la fecha no han explicado rigurosamente la edad u otros factores clave que contribuyen a la salud como potencial. factores de confusión en la predicción de riesgos. Con otras enfermedades infecciosas, las condiciones coexistentes, como la hipertensión, han sido determinantes pronósticos clave, 10 y este también parece ser el caso con Covid-19.15
Es importante tener en cuenta que, a pesar de las inferencias sobre el uso de inhibidores de RAAS de fondo, en los estudios faltaron detalles específicos. Los estudios basados en la población han estimado que solo del 30 al 40% de los pacientes en China que tienen hipertensión son tratados con alguna terapia antihipertensiva; los inhibidores de RAAS se usan solos o en combinación en 25 a 30% de estos pacientes tratados.11,12
Dadas estas estimaciones, se prevé que solo una fracción de los pacientes con Covid-19, al menos en China, hayan sido tratados previamente con inhibidores de RAAS . Se necesitan datos que muestren patrones de uso de inhibidores de RAAS y resultados de salud asociados que expliquen rigurosamente la indicación del tratamiento y la gravedad de la enfermedad entre los pacientes con Covid-19.
Efectos inciertos de los inhibidores de RAAS en ACE2 en humanos
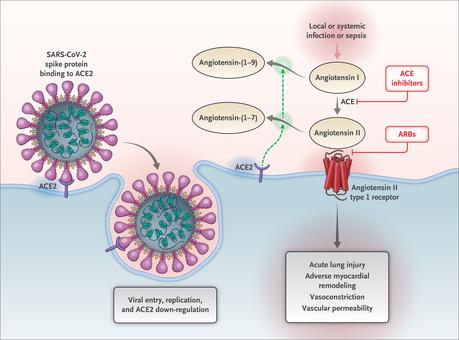
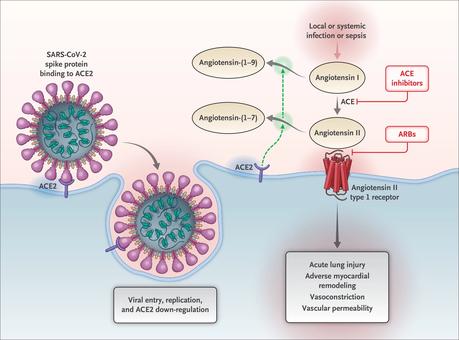 Interacción entre SARS-CoV-2 y el sistema Renina-Angiotensina-Aldosterona Se muestra la entrada inicial del coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2) en las células, principalmente los neumocitos tipo II, después de unirse a su receptor funcional, la enzima convertidora de angiotensina 2 (ACE2). Después de la endocitosis del complejo viral, la superficie ACE2 se regula aún más, lo que resulta en una acumulación de angiotensina II sin oposición. La activación local del sistema renina-angiotensina-aldosterona puede mediar las respuestas de lesión pulmonar a las agresiones virales. ACE denota enzima convertidora de angiotensina y bloqueador del receptor de angiotensina ARB.
Interacción entre SARS-CoV-2 y el sistema Renina-Angiotensina-Aldosterona Se muestra la entrada inicial del coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2) en las células, principalmente los neumocitos tipo II, después de unirse a su receptor funcional, la enzima convertidora de angiotensina 2 (ACE2). Después de la endocitosis del complejo viral, la superficie ACE2 se regula aún más, lo que resulta en una acumulación de angiotensina II sin oposición. La activación local del sistema renina-angiotensina-aldosterona puede mediar las respuestas de lesión pulmonar a las agresiones virales. ACE denota enzima convertidora de angiotensina y bloqueador del receptor de angiotensina ARB.
Los componentes circulantes y específicos de tejido del RAAS forman una red compleja de intersección de péptidos reguladores y contrarreguladores. ACE2 es una enzima contrarreguladora clave que degrada la angiotensina II a angiotensina- (1-7), atenuando así sus efectos sobre la vasoconstricción, la retención de sodio y la fibrosis.
Aunque la angiotensina II es el sustrato primario de ACE2, esa enzima también escinde la angiotensina I en angiotensina- (1-9) y participa en la hidrólisis de otros péptidos.16 En estudios en humanos, muestras de tejido de 15 órganos han demostrado que ACE2 se expresa en términos generales, incluso en el corazón y los riñones, así como en las células diana principales para el SARS-CoV-2 (y el sitio de la lesión dominante), las células epiteliales alveolares pulmonares.17 De interés, los niveles circulantes de ACE2 soluble son bajos y el papel funcional de ACE2 en los pulmones parece ser relativamente mínimo en condiciones normales18 pero puede estar regulado en ciertos estados clínicos.
Debido a que los inhibidores de la ECA y los BRA tienen diferentes efectos sobre la angiotensina II, el sustrato primario de ACE2, se puede anticipar que los efectos de estos agentes sobre los niveles y la actividad de ACE2 difieren. A pesar de la homología estructural sustancial entre ACE y ACE2, sus sitios activos enzimáticos son distintos. Como resultado, los inhibidores de la ECA en el uso clínico no afectan directamente la actividad de la ECA2.19
Los modelos animales experimentales han mostrado resultados mixtos con respecto a los efectos de los inhibidores de la ECA en los niveles de ACE2 o la actividad en los tejidos.20-25 De manera similar, los modelos animales han tenido inconsistencias. hallazgos con respecto a los efectos de los ARB en ACE2, algunos muestran que los ARB pueden aumentar la expresión de ARN mensajero o los niveles de proteína de ACE2 en el tejido21,26-34 y otros no muestran ningún efecto23.
A diferencia de los modelos animales disponibles, hay pocos estudios en humanos sobre los efectos de la inhibición de RAAS en la expresión de ACE2. En un estudio, la administración intravenosa de inhibidores de la ECA en pacientes con enfermedad de las arterias coronarias no influyó en la producción de angiotensina (1-7), un hallazgo que cuestiona si los inhibidores de la ECA tienen algún efecto directo sobre el metabolismo de la angiotensina II dirigida por la ECA.
De manera similar, en otro estudio, entre pacientes con hipertensión, los niveles de angiotensina- (1-7) no se vieron afectados después del tratamiento inicial con el inhibidor de la ECA captopril; sin embargo, con la exposición a la monoterapia con captopril durante un período de 6 meses, los niveles de angiotensina- (1-7) aumentaron.36 Además, pocos estudios han examinado la actividad plasmática de ACE2 o los niveles urinarios de ACE2 en pacientes que han recibido tratamiento a largo plazo con inhibidores de RAAS.
En estudios transversales con pacientes con insuficiencia cardíaca, 37 fibrilación auricular, 38 estenosis aórtica, 39 y enfermedad arterial coronaria, 40 la actividad plasmática de ACE2 no fue mayor entre los pacientes que estaban tomando inhibidores de la ECA o BRA que entre los pacientes no tratados. En un estudio de cohorte longitudinal que involucró a pacientes japoneses con hipertensión, los niveles de ACE2 en orina fueron más altos entre los pacientes que recibieron tratamiento a largo plazo con el olmesartán ARB que entre los pacientes control no tratados, pero esa asociación no se observó con el inhibidor de la ECA enalapril o con otros ARB ( losartán, candesartán, valsartán y telmisartán) .41
El tratamiento previo con inhibidores de la ECA se asoció con un aumento de los niveles de ARN mensajero intestinal de la ECA2 en un estudio, pero esa asociación no se observó con los BRA25; Faltan datos con respecto a los efectos de los inhibidores de RAAS en la expresión pulmonar específica de ACE2. Estos datos aparentemente conflictivos indican la complejidad subyacente en las respuestas RAAS a los moduladores de la vía y refuerzan el concepto de que los hallazgos de los modelos preclínicos pueden no traducirse fácilmente a la fisiología humana. Dichos datos sugieren que no se debe suponer que los efectos sobre ACE2 sean uniformes entre los inhibidores de RAAS o incluso en respuesta a terapias dentro de una clase de fármaco dada.41
Es importante tener en cuenta que el nivel de ACE2 en plasma puede no ser un indicador confiable de la actividad de la forma unida a la membrana de longitud completa, en parte porque ACE2 se desprende de la membrana, un proceso que parece estar regulado por separado por un inhibidor endógeno.42 Además del grado de expresión, la relevancia biológica de ACE2 puede variar según al tejido y al estado clínico.
Desafortunadamente, faltan datos que muestren los efectos de los inhibidores de ACE, ARB y otros inhibidores de RAAS en la expresión de ACE2 específica de pulmón en modelos animales experimentales y en humanos. Además, incluso si los inhibidores de RAAS modifican los niveles o la actividad de ACE2 (o ambos) en los lechos de tejido objetivo, faltan datos clínicos que indiquen si esto a su vez facilitaría un mayor compromiso y entrada de la proteína de pico de SARS-CoV-2. Se necesitan más estudios mecanicistas en humanos para definir mejor la interacción única entre SARS-CoV-2 y la red RAAS.
Potencial de beneficio en lugar de daño de los bloqueadores RAAS en Covid-19 El SARS-CoV-2 parece no solo obtener una entrada inicial a través de ACE2, sino también posteriormente regular a la baja la expresión de ACE2 de modo que la enzima no pueda ejercer efectos protectores en los órganos. Se ha postulado pero no se ha demostrado que la actividad de la angiotensina II no disminuida puede ser en parte responsable de la lesión orgánica en Covid-19.43,44 Después del compromiso inicial de la proteína del pico de SARS-CoV-2, existe una baja regulación posterior de la abundancia de ACE2 en las superficies celulares.45 La infección viral continua y la replicación contribuyen a reducir la expresión de ACE2 en la membrana, al menos in vitro en células cultivadas.46 La regulación negativa de la actividad de ACE2 en los pulmones facilita la infiltración inicial de neutrófilos en respuesta a la endotoxina bacteriana47 y puede dar lugar a la acumulación de angiotensina II sin oposición. y activación local de RAAS. De hecho, en modelos experimentales con ratones, la exposición a la proteína del pico SARS-CoV-1 indujo una lesión pulmonar aguda, que está limitada por el bloqueo RAAS.45
Otros modelos en ratones han sugerido que la desregulación de ACE2 puede mediar la lesión pulmonar aguda que es secundaria a cepas virulentas de influenza48,49 y virus sincitial respiratorio.50 En un pequeño estudio, los pacientes con Covid-19 parecían tener niveles elevados de angiotensina II en plasma, que a su vez estaban correlacionados con la carga viral total y el grado de lesión pulmonar.44
La restauración de ACE2 a través de la administración de ACE2 recombinante pareció revertir este proceso devastador de lesión pulmonar en modelos preclínicos de otras infecciones virales49,50 y redujo de forma segura los niveles de angiotensina II en un ensayo de fase 2 que evaluó el síndrome de dificultad respiratoria aguda en humanos.51
La ACE2 desregulada teóricamente también puede atenuar la cardioprotección en el contexto del compromiso miocárdico y la hemodinámica pulmonar anormal52,53 en Covid-19. Se ha demostrado que los marcadores de lesión miocárdica están elevados durante el curso de la enfermedad de Covid-1954 y aumentan rápidamente con el deterioro clínico previo y la muerte.14
Muchos virus son cardiotrópicos, y la miocarditis viral subclínica se ve comúnmente en la viremia asociada con una amplia gama de enfermedades. agentes infecciosos.
ACE2 tiene un papel bien reconocido en la recuperación del miocardio y la respuesta a lesiones; en un estudio, la eliminación de ACE2 en modelos animales contribuyó a la remodelación ventricular izquierda adversa en respuesta a una lesión aguda provocada por angiotensina II.55 En las autopsias de pacientes que murieron de SARS, el 35% de las muestras de corazón mostraron la presencia de ARN viral, que a su vez se asoció con una expresión reducida de la proteína ACE2.56
La administración de ACE2 recombinante normaliza los niveles de angiotensina II en corazones humanos explantados con miocardiopatía dilatada.57 Estas hipótesis han llevado a ensayos para probar si la provisión de proteína ACE2 recombinante puede ser beneficiosa para restablecer el equilibrio en la red RAAS y potencialmente prevenir la lesión de un órgano (ClinicalTrials.gov, NCT04287686).
Además, se están llevando a cabo ensayos emparejados de losartán como tratamiento para Covid-19 entre pacientes que no han recibido previamente tratamiento con un inhibidor de RAAS y están hospitalizados (NCT04312009) o no están hospitalizados (NCT04311177).
Mantenimiento de inhibidores RAAS con Covid-19 conocido o sospechoso A pesar de estas incertidumbres teóricas sobre si la regulación farmacológica de ACE2 puede influir en la infectividad del SARS-CoV-2, existe un claro potencial de daño relacionado con la retirada de los inhibidores de RAAS en pacientes en condiciones estables.
Covid-19 es particularmente grave en pacientes con enfermedades cardiovasculares subyacentes, 9 y en muchos de estos pacientes, se desarrollan lesiones miocárdicas activas, 14,54,58-60, estrés miocárdico 59 y cardiomiopatía59 durante el curso de la enfermedad. Los inhibidores de RAAS han establecido beneficios en la protección del riñón y el miocardio, y su retirada puede arriesgarse a la descompensación clínica en pacientes de alto riesgo.
Aunque las tasas de insuficiencia cardíaca se han informado con poca frecuencia en informes epidemiológicos de China hasta la fecha, la prevalencia de insuficiencia cardíaca entre pacientes críticos con Covid-19 en los Estados Unidos puede ser alta (> 40%) 59. En el ensayo de insuficiencia cardíaca Quinapril , entre los pacientes con insuficiencia cardíaca sintomática crónica, la retirada de quinapril resultó en una disminución progresiva del estado clínico.61 En el ensayo TRED-HF, entre los pacientes asintomáticos con insuficiencia cardíaca con fracción de eyección ventricular izquierda recuperada, la retirada gradual del tratamiento médico (incluyendo los inhibidores de RAAS) resultaron en una recaída rápida de la miocardiopatía dilatada.62
Además, los inhibidores de RAAS son la piedra angular de la terapia después del infarto de miocardio: el mantenimiento de la terapia en los días o semanas posteriores al evento índice ha demostrado reducir la mortalidad temprana.63 Entre los pacientes con estado clínico inestable, la lesión miocárdica asociada con Covid-19 puede presentar riesgos iniciales aún mayores después de la retirada de los inhibidores de RAAS.
La retirada de los inhibidores de RAAS que se administran para el tratamiento de la hipertensión puede ser menos riesgosa que la retirada de los inhibidores de RAAS que se administran para afecciones en las que se consideran terapia dirigida por la guía, pero pueden estar asociados con otros desafíos.
El cambio de un inhibidor de RAAS a otra terapia antihipertensiva en un paciente ambulatorio estable puede requerir un seguimiento cuidadoso para evitar aumentos de rebote en la presión arterial. Además, la selección de terapias antihipertensivas equivalentes a dosis puede ser un desafío en la práctica y puede depender del paciente.
Incluso los períodos pequeños y de corta duración de inestabilidad de la presión arterial después de un cambio terapéutico se han asociado con un exceso de riesgo cardiovascular64-66. Esto puede ser una consideración especialmente importante en pacientes con Covid-19, que parece dar como resultado un estado de activación de RAAS, 44 y en entornos (p. Ej., China) donde el control de la presión arterial basal se alcanza con poca frecuencia a nivel de la población.11,12
Los efectos de retirar los inhibidores de RAAS o cambiar los tratamientos son inciertos entre los pacientes con enfermedad renal crónica. Aunque las tasas informadas de enfermedad renal crónica parecen ser bajas entre los pacientes hospitalizados con Covid-19 en China (1 a 3%), la prevalencia puede ser mayor entre los pacientes que están gravemente enfermos y en otras regiones geográficas.59 Muchos pacientes tienen diversos grados de lesión renal aguda durante la enfermedad.14,67,68 Para estos pacientes de alto riesgo, se recomiendan decisiones de tratamiento individualizadas con respecto al mantenimiento de los inhibidores de RAAS que se guían por el estado hemodinámico, la función renal y la estabilidad clínica.
Sobre la base de la evidencia disponible, creemos que, a pesar de las preocupaciones teóricas y la incertidumbre con respecto al efecto de los inhibidores de RAAS en ACE2 y la forma en que estos medicamentos pueden afectar la propensión o la gravedad de Covid-19, los inhibidores de RAAS deben continuar en pacientes en condiciones estables que están en riesgo, están siendo evaluados o tienen Covid-19, una posición ahora respaldada por múltiples sociedades especializadas.
Aunque los datos adicionales pueden informar aún más el tratamiento de pacientes de alto riesgo con Covid-19, los médicos deben ser conscientes de las consecuencias involuntarias de interrumpir prematuramente las terapias probadas en respuesta a preocupaciones hipotéticas que pueden basarse en evidencia experimental incompleta.69
Puntos clave relacionados con la interacción entre Covid-19 y el sistema renina-angiotensina-aldosterona
• ACE2, una enzima que contrarresta fisiológicamente la activación de RAAS, es el receptor funcional del SARS-CoV-2, el virus responsable de la pandemia de Covid-19
• Estudios preclínicos selectos han sugerido que los inhibidores de RAAS pueden aumentar la expresión de ACE2, lo que genera dudas sobre su seguridad en pacientes con Covid-19
• No hay suficientes datos disponibles para determinar si estas observaciones se traducen fácilmente en humanos, y ningún estudio ha evaluado los efectos de los inhibidores de RAAS en Covid-19
• Se están realizando ensayos clínicos para evaluar la seguridad y la eficacia de los moduladores de RAAS, incluido el ACE2 humano recombinante y el losartán ARB en Covid-19
• La retirada brusca de los inhibidores de RAAS en pacientes de alto riesgo, incluidos aquellos con insuficiencia cardíaca o infarto de miocardio, puede provocar inestabilidad clínica y resultados adversos para la salud.
• Hasta que se disponga de más datos, creemos que los inhibidores de RAAS deben continuarse en pacientes en condiciones estables que están en riesgo de ser evaluados o con Covid-19
NEJM DOI: 10.1056/NEJMsr2005760 Renin–Angiotensin–Aldosterone System Inhibitors in Patients with Covid-19

