Problemas de equilibrio químico, tipo 4: Resolviendo problemas en los que se obtiene una ecuación cuadrática de modo manual.
En base a la siguiente reacción 
Suponga que usted comienza con 1 mol de monóxido de carbono y 50L de agua Cuantos moles de cada sustancia se encuentran en la mezcla de reacción una vez que el sistema ha alcanzado el equilibrio a 1000°C?, la constante de equilibrio es de 0,58.
Estrategia para la resolución del problema.
La solución de un problema de equilibrio se debe desglosar en tres etapas.
Paso 1: clasificar los datos dados en el problema según si son de la mezcla inicial de reacción, o de la mezcla de la reacción en equilibrio. En este problema específico solo se nos dan los datos de la mezcla inicial. En tal caso se debe determina la concentración de las especies al inicio de la reacción y luego emplear una tabla de cambios para determinar las concentraciones al final de la reacción.
Paso 2: se reemplazan las funciones en equilibrio de la tabla en la expresión para la constante de la reacción y se iguala esta al valor de la constante de equilibrio de la reacción.
Paso 3: se resuelve la ecuación resultante de manera algebráica.
En este ejemplo asumiremos que usted enfrenta a una rata de profesor que le dejará toda la mañana para hacer el ejercicio, pero sin una calculadora, ¡o celular!.
Resolución
Determinar la concentración de las especies al inicio de la reacción: Hay que tener en cuenta algunos detalles cualitativos, en primera el agua se nos entrega en el ejercicio en estado líquido, pero en base a la temperatura de la reacción podemos deducir que se encuentra realmente en estado gaseoso, lo cual nos arrojaría cierta cantidad de moles muy grande, al carecer de volumen no podríamos expresar la concentración del agua en términos de molaridad.
El problema anterior sería una causa de bloqueo en el desarrollo inicial de este problema, sin embargo viendo la reacción balanceada obtenemos que el dióxido de carbono y el agua reaccionan en una proporción 1:1, por lo que la concentración efectiva del agua será igual a la concentración efectiva del monóxido de carbono.
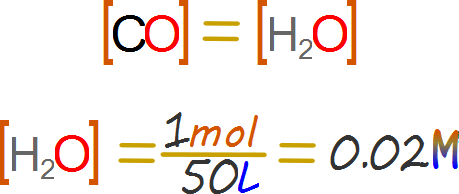
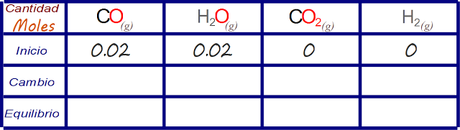
Las concentraciones iniciales de productos es igual a 0, por lo que ya podemos expresar el primer renglón de la tabla de cambios.
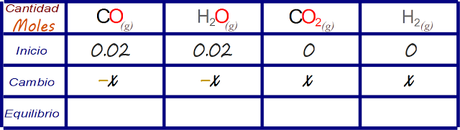
Todas las especies se relacionan 1:1 por lo que se puede reemplazar todo el renglón de cambios con el valor desconocido x
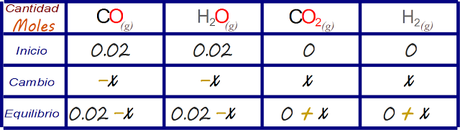
Luego se expresa el cambio neto en el tercer renglón sumando los renglones primero y segundo.
Se reemplazan las expresiones algebraicas en su respectiva variable en la expresión para la constante de equilibrio.
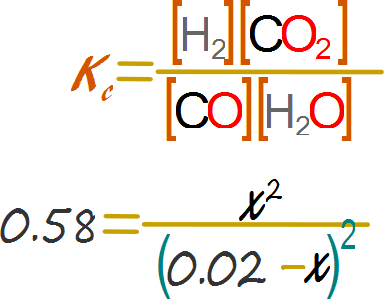
Y se realiza la manipulación algebraica.
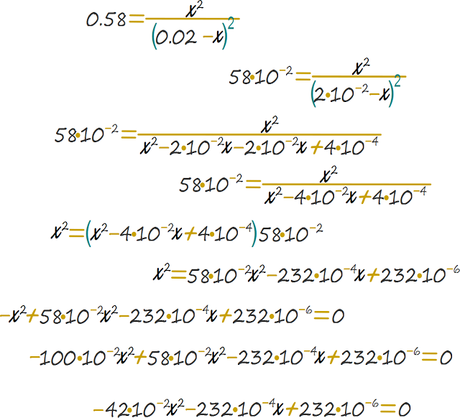
En este punto se emplea la ecuación cuadrática.
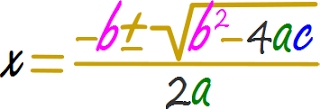
Se ubican los términos conforme a la ecuación cuadrática.
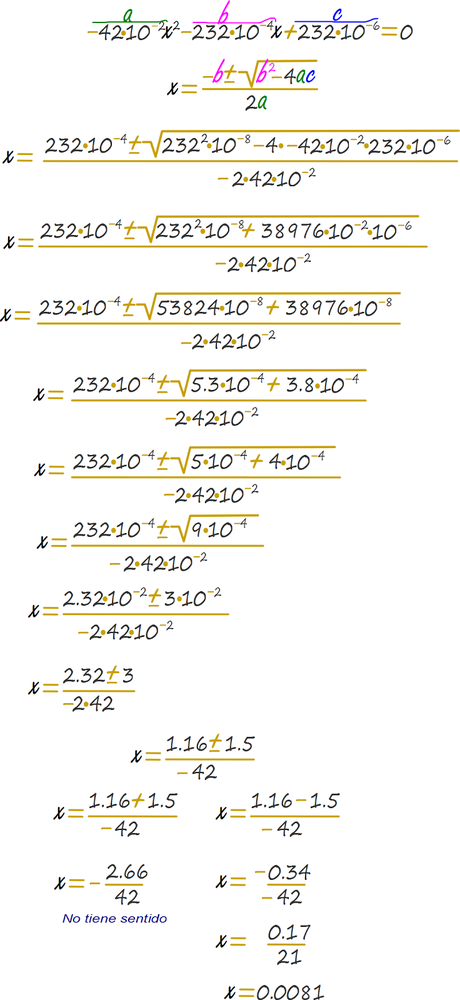
Antes de resolver la raíz se realiza un heurístico corriendo la coma por cada orden de magnitud y luego redondeando la cifra de modo tal que la raíz sea fácil de obtener, este heurístico altera levemente el valor de x de 0.0086 a 0.0081.
Se calculan las concentraciones usando las ecuaciones del tercer renglón de la tabla de cambios, de este modo la concentración en equilibrio del monóxido de carbono es de 0.012M, la del agua es de 0.012 molar; la del monóxido de carbono es de 0.0081 y la del hidrógeno 0.0081.
Este ejercicio fue realizado la mayor parte posible de manera manual, tal como se haría sin una calculadora. En el siguiente articulo veremos cómo se realizaría este mismo ejercicio, pero de forma automática empleando unas sencillas fórmulas de Excel o una calculadora. PRINCIPAL
