Cuando nos enfrentamos al reto de hacer una piscina natural uno de los principales problemas que debemos de resolver es la aparición de algas. Las algas no son dañinas para las personas pero pueden llegar a ser una molestia estéticamente y para el baño, cuando se produce un desequilibrio de nutrientes en nuestra piscina ecológica, las algas absorben los nutrientes (nitratos, fosfatos, hierro…) que hay en exceso y se produce una explosión de algas, pero para ello siempre necesitan un nutriente principal, el fósforo. Eliminando el fósforo eliminamos los portenciales problemas de algas. En este artículo vamos a analizar la problemática dels fósforo y las diversas formas de eliminarlo.

El átomo de fósforo es uno de los componentes básicos de la materia viva. Está presente en cada ser vivo y, pos supuesto, en el agua de cada biopiscina. Desafortunadamente, a menudo está presente en exceso, y ese exceso tiene el potencial de causar problemas para aquellos que diseñamos piscinas naturales. El fosfato es un nutriente limitante para el crecimiento de algas, por lo que cuando se eleva puede permitir el crecimiento excesivo de algas indeseables. Ya que la mayoría de los diseñadore de piscinas ecológicas no quieren que esto suceda, ponemos nuestro esfuerzo en mantener los niveles de fósforo bajo control. Afortunadamente, existen varias formas efectivas de mantener las concentraciones de fósforo en niveles aceptables. Cuáles son estos métodos y cuáles son los objetivos adecuados para las concentraciones de fosfato se tratarán en este artículo.

El fósforo existe en dos formas primarias: como fosfatos inorgánicos, especialmente ortofosfato, y como formas de organofosfato. El ortofosfato es absorbido fácilmente por las algas. Las formas orgánicas (organofosfatos) pueden o no estar disponibles para las algas por lo que no es seguro que promuevan su crecimiento. Los creadores de piscinas pueden cuantificar fácilmente el ortofosfato inorgánico usando un kit de prueba estándar del fosfato para acuarios, pero cuantificar los compuestos orgánicos del fósforo es considerablemente más tedioso. Por otra parte, si hay un problema de algas, estas pueden consumir el ortofosfato tan rápidamente como él entra el agua, ocultando así el problema. En consecuencia, en muchas piscinas naturales puede haber un problema de fosfato sin que esto salga en los análisis, lo único que se ve es un problema de algas.
Este artículo describe algunos de los problemas relacionados con el fósforo, incluyendo las formas que toma, sus orígenes, formas de analizarlo y, lo que es más importante, formas de eliminarlo.

El fosfato en el agua
La forma “más simple” de fósforo en el agua de mar es el ortofosfato inorgánico. Consiste en un átomo de fósforo central rodeado por cuatro átomos de oxígeno en un tetraedro (Figuras 1 y 2). Tres de estos átomos de oxígeno pueden tener un átomo de hidrógeno unido o llevar una carga negativa (Figura 2). La proporción de las diferentes formas que puede adoptar depende del pH del agua.
A concentraciones inferiores a 0,03 ppm, la tasa de crecimiento de muchas especies de fitoplancton depende de la concentración de fosfato (suponiendo que otros nutrientes, como nitrógeno o hierro, no están limitando su crecimiento). Por encima de este nivel, la tasa de crecimiento de muchos organismos es independiente de la concentración de fosfato. Por lo tanto, para disuadir el crecimiento de algas controlando el fosfato, necesitamos mantener los niveles de fosfato por debajo de 0,02 ppm.
Fosfatos orgánicos
En el agua, los compuestos orgánicos de fósforo son mucho más variados y complejos que los fosfatos inorgánicos. Muchos bioquímicos comunes contienen fósforo y cada célula viva contiene una amplia variedad de ellos. Moléculas tales como ADN, ATP, fosfolípidos (lecitina) y muchas proteínas contienen grupos fosfato. En estas moléculas, la estructura básica de fosfato está unida covalentemente al resto de la molécula orgánica a través de uno o más enlaces de éster fosfato a un átomo de carbono. Estos enlaces son estables durante algún tiempo en el agua, pero eventualmente se rompen para liberar orofosfato inorgánico de la parte orgánica de la molécula, un proceso que puede acelerarse a través de la acción de las enzimas. Muchos de estos compuestos orgánicos de fosfato se eliminarán fácilmente de un acuario mediante un skimmer de proteínas. La exportación de fosfatos orgánicos es probablemente la principal forma en que el desnatado (skimmer) puede reducir los niveles de ortofosfato inorgánico en un acuario. Los iones ortofosfato no se eliminan significativamente mediante el desnatado (skimmer) (porque no se adsorben en una interfase aire / agua), pero los fosfatos orgánicos pueden eliminarse antes de convertirlos en ortofosfatos inorgánico.
Un aspecto muy importante a tener en cuenta acerca de los fosfatos orgánicos es que no se unen fácilmente a los materiales inorgánicos que se utilizan en los productos comerciales para eliminar fosfatos. Por consiguiente, aunque estos productos pueden hacer un buen trabajo en la reducción del ortofosfato inorgánico, pueden no reducir sustancialmente los fosfatos orgánicos, dicho de otra manera, podemos seguir teniendo fosfatos orgánicos aunque utilicemos productos eliminadores de fosfatos. Los fosfatos orgánicos tampoco son detectados por la mayoría de los kits de prueba diseñados para aficionados. Los pocos que si detectan fosfatos orgánicos (por ejemplo, Hach PO-24) rompen el fosfato del compuesto orgánico, convirtiéndolo de este modo en ortofosfato inorgánico antes de la prueba. Estos kits son tediosos de usar y caros, por lo que no los recomendaré en este artículo.
El fosforo se mide enrelación con los otros dos compuestos esencialies para la vida, el nitrógeno y el carbono. La relación entre estos componentes para que cualquier ecosistema estéequilibrado debería ser 1-10-100 aproximadamente: 1 de fosforo, 10 de nitrógeno y 100 de carbono. Sobre esta relación hay que saber dos cosas:
- El fosforo es limitante en cualquier proceso de paprición de algas, es decir, si bajamos la concentración de fosforo por debajo de 0,02ppm eliminamos la proliferación de algas.
- Cualquier desequilibrio en esta proporción provocará la aparición de algas siempreque haya fósforo disponible, los desequilibrios más comunes con el exceso de fósforo y el exceso de nitrógeno.
En esta tabla se puede apreciar la posibilidad de aparición de algas en función de la proporción entre el nitrógeno y el fósforo según las hipótesis de Redfield:
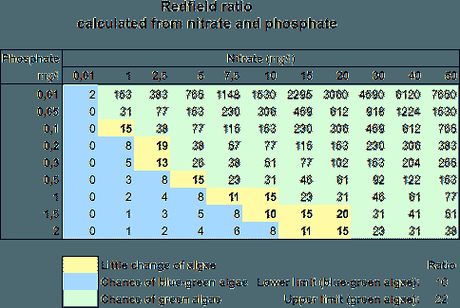
Fuentes de fósforo
En una piscina natural el fósforo puede provenir de distintas fuentes:
- Materia orgácnica que caiga a la piscina por distintos medios.
- Agua con la que se rellena la piscina.
- Escorrentía de lluvia que arrastre hacia la piscina materia orgánica o inorgánica del entorno.
- Grava la zona de regeneración y materiales de construcción de la piscina.
Los compuestos orgánicos de fósforo, así como el ortofosfato, son muy frecuentes en sistemas biológicos: animales, plantas, piel, orina, comida para peces, están compuestos por ellos. Los procesos metabólicos realizados en la descomposición de cualquier material orgánico que caiga en la biopiscina dará lugar a fosfato:
Materia orgánica + oxígeno à Dióxido de carbono + agua + hidrógeno + fosfato + nitrato
La piel que perdemos al bañarnos, la orina, hojas que caigan a la piscina pueden ser el origen de un problema de algas. Por este motivo se recomienda no colocar las piscinas naturales cerca de árboles cuyas hojas puedan caer en la misma.
El agua del grifo también puede ser una fuente significativa de fosfato. Ya hemos comentado que para no tener problemas de algas el agua debe estar por debajo de los 0,02 ppm, hay zonas donde el agua puede llegar a niveles tan altos como los 3ppm. Recomendaría la prueba del fosfato a cualquier persona con un problema de las algas que utilice el agua del grifo, para determinar si el fosfato en el agua es un problema.
En piscinas ecológicas donde la lluvia pueda arrastrár parte de la capa superficial del suelo, rica en fosfatos orgánicos e inorgánicos, cada episodio de lluvias puede suponer un problema de algas, recomendamos redirigir la escorrentía para que no entre en ningún caso en la piscina natural.
La grava que utilizamos en la zona de regeneración o como elemento filtrante del filtro biológico puede suponer una fuente de fosfatos, recomendamos analizar las gravas antes de utilizarlas en la piscina biológica.

Cómo eliminar el fosfato.
Ahora que sabemos de dónde proviene el fosfato, y qué impacto tiene, podemos proceder a preguntarno a dónde lo enviamos para que no moleste y cómo maximizamos esos procesos de exportación. Ciertamente, algo de fósforo entra en los cuerpos de organismos en crecimiento, incluyendo bacterias, algas, y peces. Algunos de estos organismos permanecen permanentemente en la piscina, y otros pueden ser eliminados: recolección de algas, poda de plantas. De estos y otros mecanismos hablaremos en las siguientes secciones:
Reducción de fosfato a través de la precipitación de fosfato de calcio
Un mecanismo para la reducción de fosfato en las piscinas naturales puede ser simplemente la precipitación de fosfato de calcio, Ca3 (PO4)2. Esta precipitación se puede dar si añadimos calcio con aditivos elevadores del pH (tales como el agua de cal, hidróxido de calcio) al agua de la piscina. El pH localmente alto convierte gran parte del HPO4 – a PO4 —, esto combinado con el nivel de calcio localmente alto puede empujar la sobresaturación de Ca3 (PO4) 2 a niveles inestables, causando la precipitación. Si estos cristales de fosfato de calcio se forman en la columna de agua (por ejemplo, si se forman en la superficie del agua de la biopiscina donde el agua de cal alcanza golpea el agua cuando la vertemos), entonces pueden verse recubiertos con compuestos orgánicos y ser desnatados fuera del sistema mediante un skimmer de proteínas.

Un mecanismo posible podría ser a través de la precipitación con fosfato cálcico, como se ha indicado anteriormente. Un segundo mecanismo para la reducción de fosfato cuando se usan aditivos elevadores del pH es la unión de fosfato a las superficies de carbonato de calcio. La absorción de fosfato del agua sobre el carbonato de calcio depende del pH, siendo el pinto óptimo en el entorno de 8,4
Sin embargo si el cristal de carbonato de calcio es estático (no crece), entonces este proceso es reversible, y el carbonato de calcio actuar como un depósito acumulador-liberador de fosfato (buffer), liberando este cuando las condiciones cambian permitiendo que las algas sigan prosperando a pesar de que las fuentes de fosfato hayan sido cortadas.
Por otro lado si los depósitos de carbonato de calcio crecen, entonces el fosfato puede quedar enterrado en el cristal en crecimiento, que puede actuar como sumidero de fosfato, al menos hasta que el CaCO3 se disuelva de alguna manera.
En resumen, el fosfato se une a las superficies de carbonato de calcio, pero solo podemos utilizar este sistema en piscinas naturales donde podamos mantener fácilmente un pH alto, en torno a 8,4. Sin embargo, esta precipitación potencial de fosfato en las superficies de carbonato de calcio en crecimiento no será tan fácilmente alcanzada con sistemas de pH bajo. El pH inhibe la precipitación del calcio y la alcalinidad en exceso como carbonato de calcio, así como la inhibición de la unión del fosfato al carbonato de calcio.
Captación de fosfato mediante organismos
La forma en que los organismos obtienen fosfato es, en casi todos los casos, poco comprendida. Incluso los mecanismos de absorción de fosfato utilizados por los humanos siguen siendo objeto de intensa investigación.
Captación de fosfato mediante organismos: Microalgas
Se dice con frecuencia que limitar el fosfato limitará el crecimiento de algas en las piscinas ecológicas. Esto es casi seguro, pero algunas especies de microalgas prosperan más fácilmente bajo la limitación de fosfato que otras. Algunas especies de microalgas pueden, de hecho, regular de manera significativa sus capacidades inorgánicas de transporte de fosfato para tratar con niveles variables de fosfato. Por último, muchos organismos pueden degradar enzimáticamente fosfatos orgánicos en ortofosfato inorgánico antes de su absorción. En resumen, tenemos una comprensión limitada de lo que los organismos hacen en nuestras piscinas naturales con el fosfato. Para complicar aún más las cosas, nuestras piscinas suelen tener composiciones de agual en términos de nutrientes (por ejemplo, nitrógeno, hierro, etc.) muy diferentes a las de los lagos o ríos por lo que no podemos extrapolar fácilmente de los estudios de fosfato en otras masas de agua para sacar conclusiones sobre nuestras piscinas naturales.
Sin embargo, muchas empresas de piscinas naturales tienen éxito en el tratamiento de problemas de algas mediante la reducción de fosfato utilizando alguno de los mecanismos detallados más adelante en este artículo. Incluso si el fosfato es muy bajo (por ejemplo, 0,02 ppm o menos), un brote de algas a menudo puede ser resuelto desviando el fosfato mediante un mecanismode captación para que no pueda ser absorbido por las algas. Como se mencionó anteriormente, a concentraciones inorgánicas de fosfato inferiores a aproximadamente 0,03 ppm, la tasa de crecimiento de muchas especies de fitoplancton depende de la concentración de fosfato (suponiendo que algo más, como el nitrógeno o el hierro, no está limitando el crecimiento). Por encima de este nivel, la tasa de crecimiento de muchos organismos es independiente de la concentración de fosfato. Por lo tanto, para evitar el crecimiento de las algas necesitamos mantener los niveles de fosfato bastante bajos.
Tener suficientes microalgas puede mantener el nivel de fosfato por debajo de 0,02 ppm. Lo mismo ocurre con las macroalgas, donde una cantidad adecuada de macroalgas puede mantener el fosfato por debajo de 0,02 ppm, y de ahí la razón de que muchos sistemas de piscinas naturales usan macroalgas para exportar fosfato. Por este motivo utilizar filtros ultravioleta puede llegar ser contraproducente, una pequeña concentración de microalgas unicelulares puede apenas ser visible o enturbiar ligeramente el agua pero ayudarnos a mantener el nivel de fosfatos a raya, si las eliminamos con un filtrado ultravioleta podemos provocaremos una subida de los niveles de fosfato y posible e indeseable explosión de algas filamentosas.
Captación de fosfato mediante organismos: Bacterias.
Un segundo medio de exportar fosfato es el crecimiento bacteriano. Este crecimiento puede estimularse añadiendo fuentes de carbono al agua. Algunas fuentes de carbono incluyen azúcar, ácido acético (vinagre) y etanol. Una variedad de sistemas comerciales, como zeovit, también parecen agregar fuentes de carbono, aunque rara vez revelan exactamente qué ingredientes contienen. Estas bacterias se alimentan de las fuentes de carbono añadido, utilizando como fuente de energía. A medida que crecen y se multiplican, necesariamente absorben nitrógeno y fósforo del agua para formar las muchas biomoléculas que contienen, tales como ADN, ARN, fosfolípidos, etc. Estas bacterias son entonces normalmente eliminadas, por ejemplo, mediante el desnatado.
Captación de fosfato mediante organismos: plantas acuáticas.
El cultivo y la recolección de plantas acuáticas puede ser una forma muy efectiva de reducir los niveles de fosfato (junto con otros nutrientes) en las piscinas naturales. Las plantas acuáticas son claramente los mayores mecanismos de exportación de fosfatos. En las biopiscinas donde properan grandes cantidades de plantas se evitan los problemas de microalgas.
Pero para que las plantas acuáticas sean un mecanismo de exportación de fósforo hay que podarlas, también las plantas sumergidas, retirando dos veces al año el exceso de vegetación. Si permitimos que partes de las plantas mueran y se pudran en la piscina estos fosfatos serán liberados de nuevo.

Exportación de fosfato utilizando ligantes.
Muchos productos de captación de phospatos se utilizan en piscinas naturales. Se trata de sólidos inorgánicos que captan el fosfato sobre sus superficies. Los más comunes son el óxido de aluminio (como el PhosGuard ™ de Seachem) y el hidróxido de óxido de hierro (como ROWA®phos, PhosBan® y Salifert Phosphate Killer ™). Estos materiales se unen principalmente ortofosfato inorgánico, pero también pueden unirse a algunos materiales orgánicos.
Muchas personas (incluyendo a mí mismo) hemos utilizado con éxito estos productos, pero tienen atributos que algunos clientes de piscinas naturales pueden estar preocupados. Las siguientes secciones de este artículo detallan estos productos, pero en general los medios de unión inorgánicos tienen el potencial de disolverse parcialmente en el agua de la piscina ecológica, liberando sus componentes primarios (aluminio y hierro, por ejemplo), así como impurezas que pueden ser incorporados en ellos. A pesar de las afirmaciones en sentido contrario, estos materiales también son susceptibles de unirse de forma reversible al fosfato, y por lo tanto pueden liberar el fosfato de vuelta al agua bajo ciertas circunstancias.
No se espera que el carbón activado se una a grandes cantidades de ortofosfato inorgánico, pero sí se une a muchos materiales orgánicos que contienen fosfato (tales como fosfolípidos). En general, sin embargo, si la reducción del fosfato es la meta principal, probablemente hay mejores maneras de lograrlo que usando carbón activado.
Algunos polímeros orgánicos están diseñados para unir el fosfato en varias formas. Aunque algunos de estos se venden en el mundo del acuario y del estanque y afirman que se unen al fosfato, tales materiales orgánicos no son muy eficaces en la unión del ortofosfato inorgánico però si se unen eficazmente a compuestos orgánicos que contienen fosfato, de manera similar al carbón activado.
Exportación de fosfato utilizando ligantes: óxido de aluminio.
El óxido de aluminio es el ingrediente principal en varios ligantes de fosfato comerciales, tales como PhosGuard ™. Estos materiales son siempre sólidos blancos. El fosfato se une fuertemente a los iones de aluminio expuestos en la superficie de los sólidos de óxido de aluminio. Se cree que el fosfato se une a superficies que contienen aluminio a través de una interacción iónica directa entre uno o dos iones de oxígeno cargados negativamente sobre el fosfato con los iones de aluminio (Al +++) expuestos en la superficie sólida. Después de la exposición al agua durante un tiempo suficiente para adsorber el fosfato, los sólidos se eliminan y los fosfatos se eliminan junto con ellos.

Desafortunadamente, el óxido de aluminio no es completamente insoluble. El aluminio se puede liberar del óxido de aluminio provocando toxicidad. Enjuagar los sólidos antes del uso puede reducir la probabilidad de que pequeñas partículas que contienen aluminio se liberen en la biopiscina, pero no impide la solubilización de iones de aluminio de las superficies sólidas.
En cualquier caso, mucha gente utiliza el óxido de aluminio con eficacia, y muchos nunca notan efectos negativos. Enjuagarlo antes de usarlo y no usar grandes cantidades de una vez limitará cualquier impacto negativo.
Exportación de fosfato utilizando ligantes: Óxido férrico / hidróxido granular / GFO.
En los últimos años, los materiales de fijación de fosfato a base de hierro se han vuelto muy populares. Estos materiales se han utilizado comercialmente para tratar el agua potable (para eliminar el arsénico, por ejemplo) y para tratar las aguas residuales (para eliminar una amplia gama de contaminantes, incluido el fosfato). Se venden bajo una variedad de marcas diferentes, incluyendo PhosBan®, Phosphate Killer ™ y ROWA®phos. Estos materiales varían en color de marrón rojizo a casi negro.
El fosfato que se une a las superficies de GFO todavía está disponible par el agua por el intercambio, por lo que la fijación es más bien temporal que permanente, es decir, que si la concentración de fosfatos es suficientemente baja el GFO vuelve a liberar el fosfato al agua.

Una preocupación al usar GFO es que puede agregar el hierro soluble al sistema. Este hierro probablemente beneficiará a las plantas acuáticas en su crecimiento pero también de las algas. La baja biodisponibilidad de hierro puede limitar el crecimiento indeseable de algas en algunas piscinas, por lo que agregar hierro podría contribuir a un problema de algas. En general, sin embargo, la mayoría de los usuarios encuentran que el uso de GFO provoca una disminución de las algas, siendo la reducción del fosfato más importante para disminuir el crecimiento de las algas de lo que el hierro agregado lo promueve.
Una segunda preocupación con el uso de GFO es la precipitación de carbonato de calcio cerca o en la propia GFO. Resulta que el hierro soluble puede causar la precipitación del carbonato de calcio. Tal precipitación puede convertir las bolsas de GFO en grumos sólidos, y puede contribuir a la obstrucción de las bombas, pero en general el efecto se limita a los objetos muy cerca de la GFO. La magnitud de este efecto puede depender del grado en el que el carbonato de calcio está sobresaturado en la piscina, así como de los niveles de magnesio y orgánicos (los cuales generalmente reducen la probabilidad de precipitación de carbonato de calcio).
Por último, asegúrese de enjuagar estos materiales en agua dulce antes de agregarlos al filtro de la piscina, ya que partículas finas pueden soltarse en el acuario, nublar y colorear el agua, y posiblemente crear otros problemas. No hay ningua disminución de la eficiencia debida al enjuague. El GFO se puede utilizar en un reactor de lecho fluidizado o en un filtro de cartucho.
Exportación de fosfato utilizando ligantes: Cloruro de lantano.
El cloruro de lantano es uno de los últimos materiales que ha saltado a la palestra en el mundo de los ligantes de fosfatos. El procedimiento que se utiliza es muy parecido al que se ha descrito inicialmente con el agua de cal, mediate la precipitación de fosfato cálcico. El cloruro de lantano (LaCl3) se une al ión de fosfato dando como lugar (LaPO4), secuestrando así el fósforo.
Se trata de un méttodo mucho más eficaz que la adsoción mediante hierro o aluminio con la ventaja añadida de que el Lantano no tiene ningún efecto tóxico como si lo tendría el Alumini, el problema viene cuando tenemos que eliminar el fosfato de lantano del agua de la piscina para que el fosfato no se vuelva a liberar, la forma más eficaz es mediante un espumador de proteinas. La retirada también se podría realizar con un filtro de arena, un método no tan eficaz pero sí más económico.

Resumen de los métodos para reducir fosfato en piscinas naturales
Mi sugerencia es que las piscinas naturales apunten a una concentración de fosfato de 0,02 ppm, o menos. Aquí está una lista de maneras en de exportar fósforo y mantener los niveles apropiados de fosfato. Se enumeran en orden de mi preferencia para abordar estos problemas:
1. Un gran ganador es el crecimiento de plantas aucáticas. No sólo hace un buen trabajo de reducir los niveles de fosfato, sino que también reduce otros nutrientes (por ejemplo, compuestos de nitrógeno). También es barato y puede beneficiar a la piscina de otras maneras, como ser un refugio para el crecimiento de pequeñas formas de vida que ayudan a alimentar y diversificar el ecosistema de la piscina.
2. El skimmer y el filtro sieve son los siguientes en prioridad . No sólo exporta formas orgánicas de fosfato, reduciendo el potencial para que se descompongan en fosfato inorgánico, sino que reduce otros nutrientes e incrementa el intercambio gaseoso.
3. El uso de agua de cal, y otros suplementos elevadores del pH para precipitar el fosfato, también son una buena opción. Puede ser una opción económica y resuelve otros dos grandes problema: mantener el calcio y la alcalinidad. Simplemente mantener el pH alto (8.4) puede ayudar a prevenir que el fosfato unido a la roca y a la arena vuelva a entrar en el agua. Permitir que el pH caiga de 7, especialmente si cae lo suficientemente bajo como para disolver parte del carbonato de calcio, puede servir para suministrar fosfato a la piscina.
4. Los agentes comerciales de unión al fosfato son claramente eficaces. Pueden ser caros y pueden tener otros inconvenientes, pero pueden conducir el fosfato inorgánico a niveles muy bajos.

