La Colitis ulcerosa, también relacionada estrechamente con la enfermedad de Crohn, no se considera
 una enfermedad autoinmune. Sin embargo, debido a que la enfermedad implica el sistema inmune del cuerpo que ataca el tracto gastrointestinal, los tratamientos para la enfermedad a menudo son compartidos para tratar enfermedades autoinmunes que implican inflamación crónica, como la artritis reumatoide. Desafortunadamente, muchos de los tratamientos para las enfermedades autoinmunes ofrecen resultados mixtos en términos de manejo de los síntomas.
una enfermedad autoinmune. Sin embargo, debido a que la enfermedad implica el sistema inmune del cuerpo que ataca el tracto gastrointestinal, los tratamientos para la enfermedad a menudo son compartidos para tratar enfermedades autoinmunes que implican inflamación crónica, como la artritis reumatoide. Desafortunadamente, muchos de los tratamientos para las enfermedades autoinmunes ofrecen resultados mixtos en términos de manejo de los síntomas.Un nuevo medicamento llamado Vedolizumab (VDZ, nombre comercial Entyvio) hecha por Takeda Pharmaceuticals EE.UU., Inc., ha sido recomendado para el tratamiento de adultos con colitis ulcerosa (CU) y la enfermedad de Crohn (CD) por el Comité Asesor gastrointestinales Medicamentos de la FDA ( GIDAC) y la Seguridad de los Medicamentos y el Comité Asesor de Gestión de Riesgos (DsaRMAC). La nueva aprobación de la FDA dará a quienes sufren de esta enfermedad una opción posible de un nuevo tratamiento.
Aunque a menudo se combinan, la UC y la CD, que son los dos tipos principales de la enfermedad inflamatoria intestinal y se comportan como enfermedades autoinmunes y presentan síntomas clínicos similares y por supuesto, tienen diferencias en la histología, la afectación intestinal extra, y las complicaciones. En el nuevo estudio con Vedolizumab, los datos se presentan de 5 ensayos de fase 3 de los cuales dos estaban en la Universidad de California y tres estaban en CD con el fin de cubrir las dos enfermedades de manera eficaz.
Lea más acerca de la enfermedad de Crohn .
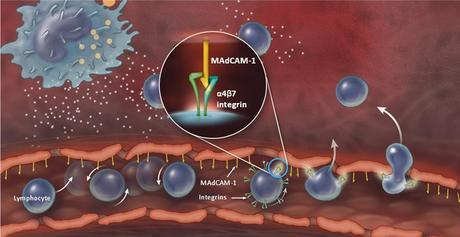
Vedolizumab es un anticuerpo monoclonal de inmunoglobulina G1 humanizado que tiene la capacidad de unirse específicamente a la integrina α4β7 que es un mediador primario de la inflamación gastrointestinal. El anticuerpo monoclonal alivia la inflamación gastrointestinal mediante la inhibición selectiva de la entrada de linfocitos promotoras de la inflamación en el tracto gastrointestinal sin bloquear la inmunidad adaptativa sistémica. VDZ se administra por vía intravenosa.
El comité votó sobre si los beneficios y los riesgos para VDZ. En particular, se miraron leucoencefalopatía multifocal progresiva (LMP) para apoyar la aprobación de la población propuesta que han fracasado a los esteroides , inmunosupresores , antagonistas del TNF, para los pacientes que han fracasado con inmunosupresores o TNF-antagonistas, o por ninguno.
En cuanto a la Colitis Ulcerosa, VDZ fue recomendado para la indicación de la reducción de los signos y síntomas, inducir y mantener la respuesta y la remisión clínica y curación de la mucosa, y para lograr la remisión corticosteroide libre en adultos con CU de moderada a severamente activa que han respondido inadecuadamente a, perdido la respuesta o eran intolerantes a la terapia convencional (incluyendo esteroides e inmunosupresores) o un factor de necrosis tumoral alfa (TNFa) antagonista. Tanto el ensayo de inducción (C13006) y el ensayo de mantenimiento (C13006) en pacientes con CU demostraron la eficacia de VDZ.
DSaRMAC miembro votante Tobias Gerhard, PhD, RPh, profesor asistente de la Universidad de Rutgers, Departamento de Práctica de Farmacia y de la Administración, Ernest Mario Facultad de Farmacia, Nueva Brunswick, Nueva Jersey, señaló: "Teniendo en cuenta que los riesgos son en este punto bastante menor en el contexto de los beneficios de la enfermedad, la flexibilidad, probablemente mayor que las preocupaciones de la limitación de la indicación [a los que han fracasado inmunosupresores o TNF, pero no esteroides] ". VDZ ha sido recomendado para los pacientes con CU que han fallado alguna de las 3 terapias. El comité votó 13 para los pacientes que han fracasado con esteroides o inmunosupresores o antagonistas del TNF a 8 para los pacientes que tienen inmunosupresores fallidos o antagonistas del TNF.
Para la enfermedad de Crohn, el comité recomendó VDZ para reducir los signos y síntomas, inducir y mantener la respuesta clínica y la remisión y la curación de la mucosa, así como para lograr la remisión-corticosteroide libre. Esto es para los adultos con EC moderada a severamente activa que no han respondido adecuadamente a pérdida de respuesta o eran intolerantes a la terapia convencional o un antagonista del TNF.
En la semana 52, sólo 1 (C13007) de los dos ensayos de inducción en pacientes con EC alcanzó su objetivo primario de la remisión clínica. Dado que sólo hubo un ensayo con datos útiles, la FDA cuestionó si las pruebas aportadas por que el juicio era lo suficientemente fuerte como para apoyar el uso de VDZ. En el segundo ensayo de inducción (C13011), el criterio principal de valoración fue la remisión clínica en la semana 6. El criterio principal de valoración no se logró en este estudio.
Según DSaRMAC miembro votante Maria Suarez-Almazor, MD, PhD, Barnts Familia Profesor Distinguido de la Universidad de Texas, MD Anderson Cancer Center en Houston, esperando una respuesta clínica a las 6 semanas después de sólo 2 dosis de VDZ es demasiado estricto requisito, y sería injustificable pedir a la empresa para hacer estudios adicionales en esta población. "Sería muchos años, y probablemente retrasar la aprobación de esta droga ... por 10 años."
El comité votó 14 para los pacientes que han fracasado con esteroides o inmunosupresores o antagonistas del TNF a 6 para los pacientes que han fracasado con inmunosupresores o antagonistas del TNF recomendar VDZ para los pacientes con EC que han fallado alguno de los 3 tratamientos, con 1 abstención.
Doce muertes cuando se informaron en los pacientes que recibieron VDZ, sin embargo, la FDA llegó a la conclusión de que ninguna de esas muertes estaban relacionadas con VDZ. También se informó de que las infecciones fueron más altos en el grupo VDZ que el placebo grupo (PBO) (43 por ciento vs 35 por ciento), sin embargo las infecciones graves fueron casi los mismos grupos de todo. El cuatro por ciento se registraron en el grupo de VDZ, un 3 por ciento en el grupo de PBO y el 3 por ciento en VDZ / PBO. Se informó de infecciones del tracto respiratorio superior (plazo de alto nivel; 24 por ciento para VDZ vs 17 por ciento de PBO). Esto parece haber conducido a la diferencia en la frecuencia de las infecciones globales entre los grupos VDZ y PBO. Infecciones virales por herpes, sobre todo en la boca, fueron reportados por 51 pacientes, sin embargo ninguno fue grave (3% VDZ / PBO, 2% PBO, y el 3% VDZ).
Ninguno de los pacientes desarrolló LMP, una infección grave que se ha asociado con un fármaco similar conocido como natalizumab. Sobre la base de la "regla de 3", la compañía estima que la tasa real de PML será inferior a 2,99 en el año 1000 con una confianza del 95% en pacientes que recibieron al menos 24 infusiones. Votaron por unanimidad que la empresa se caracteriza adecuadamente el riesgo potencial de PML con VDZ.
Comité GIDAC miembro votante Marc Wishingrad, MD, profesor clínico asistente de medicina de la División de Enfermedades Digestivas, Departamento de Medicina en la Escuela David Geffen de Medicina / Universidad de California, Los Ángeles, señaló que "el demandante presentó un buen caso para describir el mecanismo y los estudios clínicos dieron suficiente información para continuar por la recomendación de aprobación ".
Toda información mostrada en esta web es solamente para uso con carácter informativo y educativo, de ninguna manera pretendemos sustituir las opiniones, consejos y recomendaciones de un profesional sanitario. Las decisiones relativas a la salud deben ser tomadas por un profesional sanitario, considerando las características únicas del paciente.

