El pasado 29 de noviembre de 2017 fue lanzada oficialmente
la nueva versión de la norma ISO/IEC 17025 ("Requisitos
generales para la competencia de los laboratorios de ensayo
y de calibración"). Estamos, por lo tanto, ante la
tercera edición de este estándar: ISO/IEC 17025:2017.
Había muchas expectativas sobre este lanzamiento, cuya
redacción comenzó en febrero de 2015 y que fue postergándose
en el tiempo en varias oportunidades. Y no es para menos.
Estamos hablando de la norma por excelencia para la gestión
de la calidad en laboratorios de calibración y ensayo. Es la
que tiene mayor aceptación internacional. Está alineada con
ISO 9001, por lo que con la aparición de su versión 2015 se
esperaba que apareciera inmediatamente la última revisión de
ISO/IEC 17025. Pero transcurrieron casi tres años
hasta que finalmente sucedió.
En una publicación
anterior, analizamos algunas diferencias
potenciales que podía tener la última versión de la norma
con respecto a la que se encontraba vigente en ese momento (ISO/IEC
17025:2005). Nos basamos, para esto, en un draft que
apareció a fines de 2015. Algunos aspectos se mantuvieron, y
otros se modificaron. Como suele suceder con las últimas
versiones de normas de gestión ISO, se establece un período
de transición máximo de 3(tres) años para laboratorios que
tengan implementados la versión anterior. Para laboratorios
que quieran implementar la norma por primera vez, se
recomienda que lo hagan ya bajo la nueva versión.
Como vimos, este estándar se encuentra alineado en cierta
manera con ISO 9001, por lo que parte de las novedades que
trae la nueva ISO/IEC 17025tienen que ver con
aspectos que aparecieron en ISO 9001:2015. Por
ejemplo, uno de los aspectos más importantes de ISO/IEC 17025:2017 es
la aparición del concepto de riesgo. La norma hoy
exige la identificación y abordaje de riesgos y
oportunidades. Esto implica un serie de cambios que afectan
directa e indirectamente a requisitos que ya existían en
versiones anteriores: imparcialidad, confidencialidad,
acciones correctivas, aseguramiento de la validez de los
resultados, etc. También desaparecen algunos términos, como
el de acción preventiva. Posee un mayor enfoque en
los procesos, y menor exigencia documental.
Estructura de la versión anterior ISO/IEC 17025:2005
La versión anterior contaba con 5 puntos y 2 anexos:
·
El Punto 1 brindaba el Alcance.
·
El Punto 2 indicaba las referencias normativas, todos
los documentos que fueron tomados de base para la redacción
de la Norma: ISO 17000 y VIM.
·
El Punto 3 hacía referencia a las definiciones
técnicas necesarias para la comprensión de la Norma, las
cuales eran redireccionadas a dos documentos: la ISO/IEC
17000 y el VIM.
·
El Punto 4 establecía los requerimientos de gestión:
la necesidad de un sistema de gestión de la calidad, el
control de documentos, servicio al cliente, la mejora
continua, etc.
·
El Punto 5 era el que diferenciaba a esta Norma de
otras de manera notoria. En él se definían todos los
requerimientos técnicos que debía cumplimentar el
laboratorio. La competencia del personal, el equipamiento
adecuados, los métodos validados de calibración y ensayo y
la manera de tomar y expresar los resultados eran los más
importantes.
Como información adicional, la Norma contenía dos anexos:
·
Anexo A con
una tabla comparativa entre ISO/IEC 17025 e ISO
9001:2000 (la cual perdió validez con la revisión de la
ISO 9001 en 2008 y se acentuó en 2015).
·
Anexo B con
una guía para establecer aplicaciones en campos específicos.
Estructura de la nueva versión ISO/IEC 17025:2017
La nueva versión está conformada por 8 puntos y 2 anexos:
·
El Punto 1 brinda el Alcance y, salvo algunos
detalles menores y modificaciones en la redacción (quedó más
sintético), es muy similar al de la versión anterior.
·
El Punto 2 en esta oportunidad también hace mención a
las referencias normativas. Se agrega la ISO 9000 como
referencia y se mantienen las anteriores.
·
El Punto 3 aquí también establece términos y
definiciones, basándose en los documentos mencionados en el
Punto 2, aunque por comodidad indica explícitamente las
definiciones completas de varios términos de uso habitual. Quejas, comparación
interlaboratorio, método y validación son
sólo algunos ejemplos.
·
Aquí es donde comienzan las diferencias sustanciales en la
estructura de la Norma.
·
El Punto 4 habla de los requerimientos
generales: la imparcialidad y la confidencialidad.
Si bien estos puntos se mencionan en varias oportunidades en
la versión anterior, aquí se les dedicó una sección
completa. Son puntos sumamente importantes para un
laboratorio libre de intereses ajenos a la propia actividad
técnica.
·
El Punto 5 establece los requerimientos
estructurales. Aquí se define cómo debe estar
organizado el laboratorio y cómo debe interactuar con el
entorno: clientes, stakeholders, la legislación. Es casi
idéntico al Punto 4.1 de la versión anterior.
·
El Punto 6 define los requerimientos de los
recursos: el personal, el equipamiento, las
condiciones ambientales, la trazabilidad metrológica y las
compras y subcontrataciones se incluyen en este punto.
Corresponde a gran parte del Punto 5 de la versión anterior
y algo del Punto 4.
·
El Punto 7 indica los requerimientos de los
procesos: revisión de los contratos, métodos de
muestreo, evaluación de la incertidumbre, expresión de los
resultados, manipulación de los ítems de calibración,
validación de los métodos. Comprende el resto del Punto 5 de
la versión anterior y poco del Punto 4 para completarlo. Se
agrega como requisito el control de los datos y la gestión
de la información.
·
El Punto 8, por último, detalla los requerimientos
de gestión: control de documentos y registros,
mejora, acciones correctivas, auditorías internas y revisión
por la dirección. Gran parte del Punto 4 de la versión
anterior se encuentra aquí. Como requisito nuevo y
fundamental, se exige el abordaje de los riesgos y las
oportunidades. En este Punto 8 aparece otra gran diferencia
con la versión anterior, algo muy interesante. La Norma
permite dos alternativas, en función de la actividad de
nuestro laboratorio. Una Opción A y una opción B están
disponibles. Para cumplimentar con la ISO/IEC 17025 nueva
versión debemos:
o
Opción A: Cumplir
los requisitos de gestión indicados explícitamente (control
de documentos y registros, mejora, acciones correctivas,
auditorías internas y revisión por la dirección). Al igual
que en la nueva versión de la ISO 9001 (ISO 9001:2015)
desaparece el concepto de acción preventiva.
o
Opción B: Contar
con un sistema de gestión de la calidad existente bajo ISO
9001, lo que nos exceptúa de verificarlo en ISO/IEC 17025,
ya que se se supone que con ISO 9001 ya se contemplan dichos
requerimientos.
Los dos anexos que completan la Norma son del tipo
informativo:
·
El Anexo A brinda información sobre trazabilidad
metrológica.
·
El Anexo B lo hace con respecto a sistemas de
gestión.
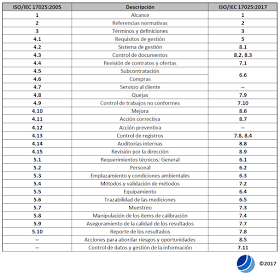
A continuación, pueden ver la tabla comparativa entre la
versión anterior ISO/IEC 17025:2005 y la nueva
versión ISO/IEC 17025:2017:
El pasado 29 de noviembre de 2017 fue lanzada oficialmente
la nueva versión de la norma ISO/IEC 17025 ("Requisitos
generales para la competencia de los laboratorios de ensayo
y de calibración"). Estamos, por lo tanto, ante la
tercera edición de este estándar: ISO/IEC 17025:2017.
Había muchas expectativas sobre este lanzamiento, cuya
redacción comenzó en febrero de 2015 y que fue postergándose
en el tiempo en varias oportunidades. Y no es para menos.
Estamos hablando de la norma por excelencia para la gestión
de la calidad en laboratorios de calibración y ensayo. Es la
que tiene mayor aceptación internacional. Está alineada con
ISO 9001, por lo que con la aparición de su versión 2015 se
esperaba que apareciera inmediatamente la última revisión de
ISO/IEC 17025. Pero transcurrieron casi tres años
hasta que finalmente sucedió.
En una publicación
anterior, analizamos algunas diferencias
potenciales que podía tener la última versión de la norma
con respecto a la que se encontraba vigente en ese momento (ISO/IEC
17025:2005). Nos basamos, para esto, en un draft que
apareció a fines de 2015. Algunos aspectos se mantuvieron, y
otros se modificaron. Como suele suceder con las últimas
versiones de normas de gestión ISO, se establece un período
de transición máximo de 3(tres) años para laboratorios que
tengan implementados la versión anterior. Para laboratorios
que quieran implementar la norma por primera vez, se
recomienda que lo hagan ya bajo la nueva versión.
Como vimos, este estándar se encuentra alineado en cierta
manera con ISO 9001, por lo que parte de las novedades que
trae la nueva ISO/IEC 17025tienen que ver con
aspectos que aparecieron en ISO 9001:2015. Por
ejemplo, uno de los aspectos más importantes de ISO/IEC 17025:2017 es
la aparición del concepto de riesgo. La norma hoy
exige la identificación y abordaje de riesgos y
oportunidades. Esto implica un serie de cambios que afectan
directa e indirectamente a requisitos que ya existían en
versiones anteriores: imparcialidad, confidencialidad,
acciones correctivas, aseguramiento de la validez de los
resultados, etc. También desaparecen algunos términos, como
el de acción preventiva. Posee un mayor enfoque en
los procesos, y menor exigencia documental.
Estructura de la versión anterior ISO/IEC 17025:2005
La versión anterior contaba con 5 puntos y 2 anexos:
·
El Punto 1 brindaba el Alcance.
·
El Punto 2 indicaba las referencias normativas, todos
los documentos que fueron tomados de base para la redacción
de la Norma: ISO 17000 y VIM.
·
El Punto 3 hacía referencia a las definiciones
técnicas necesarias para la comprensión de la Norma, las
cuales eran redireccionadas a dos documentos: la ISO/IEC
17000 y el VIM.
·
El Punto 4 establecía los requerimientos de gestión:
la necesidad de un sistema de gestión de la calidad, el
control de documentos, servicio al cliente, la mejora
continua, etc.
·
El Punto 5 era el que diferenciaba a esta Norma de
otras de manera notoria. En él se definían todos los
requerimientos técnicos que debía cumplimentar el
laboratorio. La competencia del personal, el equipamiento
adecuados, los métodos validados de calibración y ensayo y
la manera de tomar y expresar los resultados eran los más
importantes.
Como información adicional, la Norma contenía dos anexos:
·
Anexo A con
una tabla comparativa entre ISO/IEC 17025 e ISO
9001:2000 (la cual perdió validez con la revisión de la
ISO 9001 en 2008 y se acentuó en 2015).
·
Anexo B con
una guía para establecer aplicaciones en campos específicos.
Estructura de la nueva versión ISO/IEC 17025:2017
La nueva versión está conformada por 8 puntos y 2 anexos:
·
El Punto 1 brinda el Alcance y, salvo algunos
detalles menores y modificaciones en la redacción (quedó más
sintético), es muy similar al de la versión anterior.
·
El Punto 2 en esta oportunidad también hace mención a
las referencias normativas. Se agrega la ISO 9000 como
referencia y se mantienen las anteriores.
·
El Punto 3 aquí también establece términos y
definiciones, basándose en los documentos mencionados en el
Punto 2, aunque por comodidad indica explícitamente las
definiciones completas de varios términos de uso habitual. Quejas, comparación
interlaboratorio, método y validación son
sólo algunos ejemplos.
·
Aquí es donde comienzan las diferencias sustanciales en la
estructura de la Norma.
·
El Punto 4 habla de los requerimientos
generales: la imparcialidad y la confidencialidad.
Si bien estos puntos se mencionan en varias oportunidades en
la versión anterior, aquí se les dedicó una sección
completa. Son puntos sumamente importantes para un
laboratorio libre de intereses ajenos a la propia actividad
técnica.
·
El Punto 5 establece los requerimientos
estructurales. Aquí se define cómo debe estar
organizado el laboratorio y cómo debe interactuar con el
entorno: clientes, stakeholders, la legislación. Es casi
idéntico al Punto 4.1 de la versión anterior.
·
El Punto 6 define los requerimientos de los
recursos: el personal, el equipamiento, las
condiciones ambientales, la trazabilidad metrológica y las
compras y subcontrataciones se incluyen en este punto.
Corresponde a gran parte del Punto 5 de la versión anterior
y algo del Punto 4.
·
El Punto 7 indica los requerimientos de los
procesos: revisión de los contratos, métodos de
muestreo, evaluación de la incertidumbre, expresión de los
resultados, manipulación de los ítems de calibración,
validación de los métodos. Comprende el resto del Punto 5 de
la versión anterior y poco del Punto 4 para completarlo. Se
agrega como requisito el control de los datos y la gestión
de la información.
·
El Punto 8, por último, detalla los requerimientos
de gestión: control de documentos y registros,
mejora, acciones correctivas, auditorías internas y revisión
por la dirección. Gran parte del Punto 4 de la versión
anterior se encuentra aquí. Como requisito nuevo y
fundamental, se exige el abordaje de los riesgos y las
oportunidades. En este Punto 8 aparece otra gran diferencia
con la versión anterior, algo muy interesante. La Norma
permite dos alternativas, en función de la actividad de
nuestro laboratorio. Una Opción A y una opción B están
disponibles. Para cumplimentar con la ISO/IEC 17025 nueva
versión debemos:
o
Opción A: Cumplir
los requisitos de gestión indicados explícitamente (control
de documentos y registros, mejora, acciones correctivas,
auditorías internas y revisión por la dirección). Al igual
que en la nueva versión de la ISO 9001 (ISO 9001:2015)
desaparece el concepto de acción preventiva.
o
Opción B: Contar
con un sistema de gestión de la calidad existente bajo ISO
9001, lo que nos exceptúa de verificarlo en ISO/IEC 17025,
ya que se se supone que con ISO 9001 ya se contemplan dichos
requerimientos.
Los dos anexos que completan la Norma son del tipo
informativo:
·
El Anexo A brinda información sobre trazabilidad
metrológica.
·
El Anexo B lo hace con respecto a sistemas de
gestión.
A continuación, pueden ver la tabla comparativa entre la
versión anterior ISO/IEC 17025:2005 y la nueva
versión ISO/IEC 17025:2017: