Sin embargo, esta visión está a enorme distancia de la realidad. En un organismo pluricelular, en particular en los animales, el número y el tamaño de las células se regulan para permitir que el organismo en su conjunto funcione adecuadamente. Para conseguir este control, no solo es necesario que se tomen decisiones acerca de cuándo una célula debe dividirse, sino que también deben eliminarse aquellas células que ya no son necesarias para el conjunto, para lo cual existen mecanismos fisiológicos de muerte celular programada.
Dividirse o no dividirse...
No todas las células de un organismo se dividen de forma repetida. De hecho, muchas de ellas lo hacen unas pocas veces, o incluso ninguna. Desde esta perspectiva pueden diferenciarse tres grandes categorías celulares dentro de un individuo: las células lábiles son las que atraviesan sucesivos ciclos de división. Suelen encontrarse en tejidos sujetos a un importante deterioro, como la epidermis o las mucosas de los aparatos digestivo y respiratorio, y sus continuas divisiones tienen como finalidad remplazar a las que han sido eliminadas en el seno del mismo tejido. En el otro extremo del abanico se encuentran las células permanentes. Se trata de células muy especializadas, como las musculares o las nerviosas, que han perdido totalmente (o casi totalmente) la capacidad para reproducirse. Entre ambos tipos se encuentran las células estables, que constituyen la mayor parte de los tejidos de un organismo. Las células permanentes y las estables se encuentran en la fase G0 del ciclo celular, aunque siguen manteniendo la capacidad de dividirse, lo que hacen después de que se haya producido una agresión con el resultado de muerte de otras células de su entorno. La entrada en mitosis de las células estables o permanentes está regulada, y solo se produce cuando estas células reciben ciertos estímulos externos, los llamados factores mitógenos.
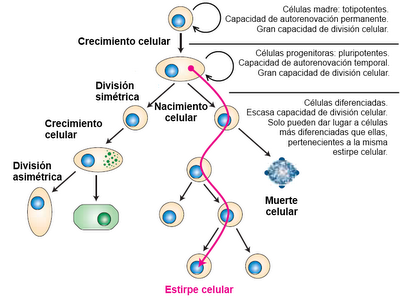
Hay otra perspectiva interesante que considerar: la capacidad potencial de las células de seguir ciclos de división que den lugar a otras células, similares a ellas o más diferenciadas. Desde este punto de vista, las células de un organismo se pueden clasificar en tres tipos: células madre, células precursoras y células diferenciadas. Las células madre totipotentes son capaces de autorrenovarse indefinidamente y de dar lugar a la formación de células de diferentes tipos si reciben los estímulos adecuados. Las células precursoras (o progenitoras), tienen carácter pluripotente. Estas células pueden dar lugar a otras similares a ellas mismas, pero esta capacidad de renovación es solo temporal. Por otra parte, también son capaces de dar lugar a algunos tipos celulares diferentes a ellas mismas, aunque solo a unas cuantas estirpes distintas. Por último, las células diferenciadas solo pueden dividirse un número limitado de veces y que son unipotentes, porque sus divisiones dan lugar a un solo tipo celular. En general, las divisiones dan lugar a células idénticas a las progenitoras, pero también puede ocurrir que las células hijas sean algo más especializadas que las progenitoras, pero siempre pertenecen a la misma estirpe celular que las células originales.
La historia de la familia
Las células adultas del organismo son el producto de una línea ininterrumpida de divisiones celulares que las relaciona directamente con el cigoto a través de una serie de células que son sus "antepasadas" y que constituyen su estirpe celular.
El cigoto es una célula particular desde el punto de vista de su ciclo vital. Se trata de una célula totipotente, porque va a dar lugar a todos los tipos celulares del organismo, pero que no puede autorenovarse, ya que su división da lugar a dos células diferentes a ella. Los productos de las primeras divisiones del cigoto son igualmente células totipotentes: las ocho primeras células formadas en el desarrollo embrionario del ratón tienen capacidad para generar, cada una de ellas, un ratón completo si son separadas de forma natural (gemelos monocigóticos) o artificial.
Este tipo de células reciben el nombre de células madre embrionarias, y se caracterizan por mantener permanentemente su capacidad de autorenovación (mediante divisiones celulares simétricas) y por poder originar todos los tipos celulares del organismo, en presencia de los factores de crecimiento y diferenciación adecuados. Cuando el embrión de ratón sufre una división más (en el estadío de 16 células), se pierde esa totipotencia absoluta, de modo que la separación de los elementos ya no permite generar embriones completos. Se habla entonces de células madres de potencial restringido.
Las células madre con potencial restringido, cuando se dividen, lo hacen de modo asimétrico: una de las células conserva su capacidad totipotente, contribuyendo al mantenimiento del número de células madre en el órgano del que forman parte, pero la otra se transforma en una célula precursora. Las células precursoras son pluripotentes, lo que significa que solo pueden dar lugar a un número limitado de estirpes celulares. Su capacidad de reproducción también es limitada, de modo que, incluso en las mejores condiciones, solo pueden sufrir un cierto número de ciclos de división, al cabo de las cuales mueren. Este número de divisiones máximo queda "fijado" en las células que derivan de esta precursora, de modo que en generaciones sucesivas el número de ciclos reproductivos se va reduciendo progresivamente, aun cuando las células se cultiven en medios "frescos" (libres de otras células) y con todos los factores de crecimiento posibles. Este proceso de envejecimiento recibe el nombre de senescencia celular.
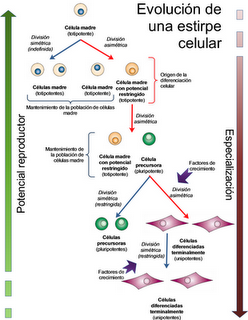 La presencia en el entorno de las células precursoras de ciertas sustancias (factores de crecimiento) hace que éstas sigan procesos de división asimétrica, que van a dar lugar a células más diferenciadas que sus progenitoras. El proceso puede ser complejo, incluyendo la intervención de diferentes combinaciones de estas sustancias que dan lugar a la aparición de diferentes tipos celulares para cada combinación de factores. Un ejemplo típico es la hematopoyesis, en la que a partir de un único tipo celular pueden formarse todos los tipos de células sanguíneas gracias a la presencia de diferentes factores de crecimiento, que interaccionan entre sí de un modo bastante complicado.
La presencia en el entorno de las células precursoras de ciertas sustancias (factores de crecimiento) hace que éstas sigan procesos de división asimétrica, que van a dar lugar a células más diferenciadas que sus progenitoras. El proceso puede ser complejo, incluyendo la intervención de diferentes combinaciones de estas sustancias que dan lugar a la aparición de diferentes tipos celulares para cada combinación de factores. Un ejemplo típico es la hematopoyesis, en la que a partir de un único tipo celular pueden formarse todos los tipos de células sanguíneas gracias a la presencia de diferentes factores de crecimiento, que interaccionan entre sí de un modo bastante complicado.¿En qué fase del ciclo está...?
Aún recuerdo la ocasión en que le pregunté a mi profesor de Citología acerca de la fase del ciclo en la que se encuentra una célula que no va a volver a dividirse. La respuesta, como me merecía, fue otra pregunta: "¿En qué mes del embarazo está una mujer que no está embarazada?". A continuación, no perdió la oportunidad de hacer un juego de palabras para redondear la explicación: "El ciclo celular is not a cycle, is a bicycle".
Al salir de una mitosis, la célula entra, en principio, en una fase G1. Sin embargo, para que esta etapa avance es necesario que el medio le proporcione determinados factores de crecimiento producidos por las células que la rodean. Si esto no ocurre, la célula inicia un periodo denominado G0 que en muchos textos es definido como una fase de quiescencia.
No existen diferencias morfológicas ni estructurales entre las células que se encuentran en G1 y las que están en G0. Más aún, en respuesta a los estímulos adecuados la célula quiescente puede activarse, pasando a una fase G1 y siguiendo el ciclo hacia el proceso de división. Este es el mecanismo que se produce cuando una célula diferenciada de un tejido debe dividirse para reemplazar a otra que ha muerto.
Sin embargo, sí que existen diferencias bioquímicas entre ambos periodos. La tasa de síntesis de proteínas es considerablemente más baja en las células que se encuentran en G0, ya que no tienen la necesidad de crecer rápidamente, y también son distintos los genes que se expresan. En concreto, las proteínas reguladoras del ciclo celular (quinasas dependientes de ciclinas, por ejemplo). También parece haber diferencia en las variantes de las histonas que se expresan en ambas fases, en relación con las funciones reguladoras de la expresión génica que realizan estas proteínas.
Envejecimiento celular
Las células que se dividen activamente llegan a alcanzar un estado que se denomina senescencia celular. Parece bien establecido que la entrada en esta fase se debe al acortamiento de los telómeros de los cromosomas: los extremos terminales de los cromosomas están constituidos por un gran número de repeticiones de una secuencia rica en G+C, que no se replica normalmente en los periodos S del ciclo celular. En vez ello, en cada replicación del ADN quedan sin copiar entre 50 y 200 pares de bases, con lo que los telómeros se van acortando progresivamente.
En las células germinales este acortamiento es compensado por la acción de una enzima, la telomerasa, que añade el fragmento que falta, pero en las células no totipotentes no se expresa la telomerasa, por lo que los telómeros van reduciendo su tamaño. Cuando alcanzan un tamaño crítico (unos 4-6 Kb frente a una longitud normal de 10-15 Kb) la célula deja de replicarse y adquiere características morfológicas y fisiológicas diferentes. Ha alcanzado el periodo de senescencia.
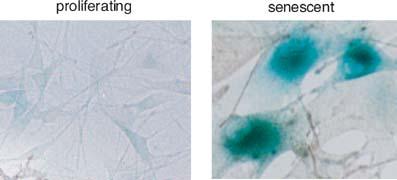 Las células senescentes pueden distinguirse por su aspecto característico: suelen presentar una morfología aplanada y alargada, mostrando la formación de focos de heterocromatina en el núcleo y la acumulación de gránulos de lipofucsina, un pigmento marrón-dorado compuesto por lipoproteínas y que se forma en los lisosomas como resultado de la oxidación de los ácidos grasos insaturados.
Las células senescentes pueden distinguirse por su aspecto característico: suelen presentar una morfología aplanada y alargada, mostrando la formación de focos de heterocromatina en el núcleo y la acumulación de gránulos de lipofucsina, un pigmento marrón-dorado compuesto por lipoproteínas y que se forma en los lisosomas como resultado de la oxidación de los ácidos grasos insaturados.Otra característica importante de las células senescentes es que incrementan su actividad secretora, vertiendo a su entorno cantidades considerables de diferentes proteínas, mayoritariamente con actividad proteolítica o, en general, hidrolítica, además de compuestos que desencadenan respuestas inflamatorias en el tejido circundante (citoquinas) y algunos factores de crecimiento. Se ha sugerido que estas sustancias podrían alterar el funcionamiento del tejido, e incluso serían responsables de ciertas efermedades, entre las que se han propuesto la arteriosclerosis o la psoriasis.
La causa fisiológica más habitual de la senescencia celular es el acortamiento de los telómeros, pero hay otros fenómenos que también pueden provocarla, como los daños en el ADN o las respuestas erróneas de la célula a los factores de crecimiento y proliferación que recibe.
La muerte celular
El funcionamiento normal de un organismo pluricelular puede requerir, en ciertas ocasiones, la muerte de algunas de sus células como un mecanismo más que contribuya a mantener su homeostasis. En ciertos casos, será necesario que las células dañadas sean eliminadas, para que su funcionamiento incorrecto no perjudique al resto, mientras que en otras ocasiones, incluso, la muerte celular puede ser imprescindible para que prosiga el propio desarrollo del individuo, como es el caso de la metamorfosis de los insectos, o la individualización de los dedos durante el desarrollo embrionario de mamíferos. Por eso no es extraño que las células posean, en su programación genética, mecanismos que den lugar a su propia desaparición, mediante lo que se ha dado en llamar muerte celular programada o, de un modo un tanto más literario, suicidio celular programado.
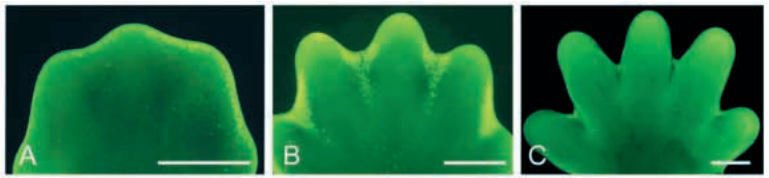
Apoptosis en el desarrollo embrionario de los dedos
De hecho, existen diferentes mecanismos de muerte celular programada, que se desencadenan cuando la célula atraviesa distintas circunstancias. El más conocido de todos ellos es la apoptosis, que se produce durante los periodos de desarrollo, pero las células también pueden morir siguiendo mecanismos bioquímicos diferentes, tales como la necrosis, o la catástrofe mitótica. Los genes y las proteínas implicadas en cada caso son diferentes, como también lo son los procesos celulares que se desencadenan y el aspecto de las células que mueren.Atendiendo a las causas que pueden provocar la muerte de las células nos encontramos, en primer lugar, con la muerte programada que tiene lugar durante un proceso de desarrollo. En este caso, el mecanismo celular que tiene lugar se conoce como apoptosis, neologismo derivado del griego que significa "caída de". La apoptosis se desencadena como resultado de la acción de factores estimulantes, procedentes del exterior de la célula, que se unen a receptores específicos situados en la membrana plasmática, a los que se da el nombre de "receptores de muerte". La transducción de esta señal provoca la activación de un conjunto de proteínas denominadas caspasas. Se trata de enzimas proteolíticas que están presentes en la célula en forma inactiva, y que responden a un mecanismo de regulación en cascada. A lo largo de la apoptosis, en el núcleo el ADN se fragmenta y se forman gránulos de heterocromatina, mientras que en el citoplasma la estructura de los orgánulos se conserva, pero la célula se divide en burbujas ("blebs") que encierran los diferentes elementos celulares. Finalmente, los blebs son eliminados por el sistema inmunitario del organismo.
Cuando la célula sufre falta de nutrientes se desencadena en ella un proceso llamado autofagia. En el citoplasma se forman sistemas de doble membrana que envuelven a los orgánulos formando vesículas que posteriormente se fusionan con los lisosomas, dando lugar a unos cuerpos que reciben el nombre de autofagosomas. En su interior, las proteasas de los lisosomas destruyen los orgánulos atrapados. Simultáneamente a este proceso (macroautofagia) se produce también la digestión de los componentes solubles del citoplasma (microautofagia).
Realmente la autofagia no es un mecanismo de muerte celular, sino un procedimiento que permite el reciclaje de los componentes celulares. Sin embargo, si la falta de nutrientes se mantiene, o si los mecanismos de apoptosis fallan, la autofagia sí puede desembocar en la destrucción irreversible de la célula.
La muerte celular también puede deberse a errores en el funcionamiento de la propìa célula. En particular, la división celular es un momento delicado y muy controlado de la vida de la célula, y si en uno de los puntos de control del ciclo se detecta un error se desencadena un mecanismo específico de muerte celular: la catástrofe mitótica. En este caso se produce micronucleación y plurinucleación, es decir, el núcleo se rompe en múltiples fragmentos más pequeños.
Por último, cuando la célula sufre algún tipo de daño tanto interno (fallos metabólicos o genéticos, por ejemplo) como externo (choque osmótico, hipoxia...) acaba produciéndose un proceso de necrosis, diferente de la apoptosis y que sigue mecanismos moleculares diferentes. Los orgánulos se deforman, especialmente las mitocondrias y el retículo. La célula aumenta su volumen, y se incrementa la presión interior hasta que la membrana plasmática acaba por estallar. A diferencia de lo que ocurre en la apoptosis, en la necrosis no se produce la formación de heterocromatina ni la rotura del ADN.
En realidad, el panorama de la muerte celular es más complejo. Se han descrito otros mecanismos menos habituales (paraptosis, piroptosis, mitoptosis...) y queda por comprender correctamente el papel fisiológico que juegan cada uno de los mecanismos, y su relación con diferentes enfermedades, en particular con el cáncer. Lo que sí está claro es que el envejecimiento y la muerte de las células son una parte sustancial de la vida de los organismos pluricelulares.
