Resumen:
La regeneración de apéndices (extremidades) es un complejo y fascinante proceso biológico presente en algunos vertebrados como anfibios urodelos y peces teleósteos. En la actualidad se busca identificar nuevas moléculas que controlen la formación y funcionamiento del blastema de regeneración, una masa mesenquimal proliferativa que emerge poco después de la amputación de la aleta o extremidad y sirve como tejido progenitor para volver a formar las estructuras perdidas. Dos estudios publicados recientemente han revelado nuevos reguladores moleculares de la proliferación del blastema. Después de la amputación de una extremidad en el tritón, la vaina de mielina del nervio libera “nAG”, un mitógeno que facilita la regeneración. En la regeneración de la cola amputada del pez cebra es optimizada a través de la disminución del microRNA “miR-133”, un mecanismo que requiere la señalización Fgf. Estos descubrimientos establecen vías de investigación que pueden afectar la capacidad regenerativa de los tejidos mamíferos.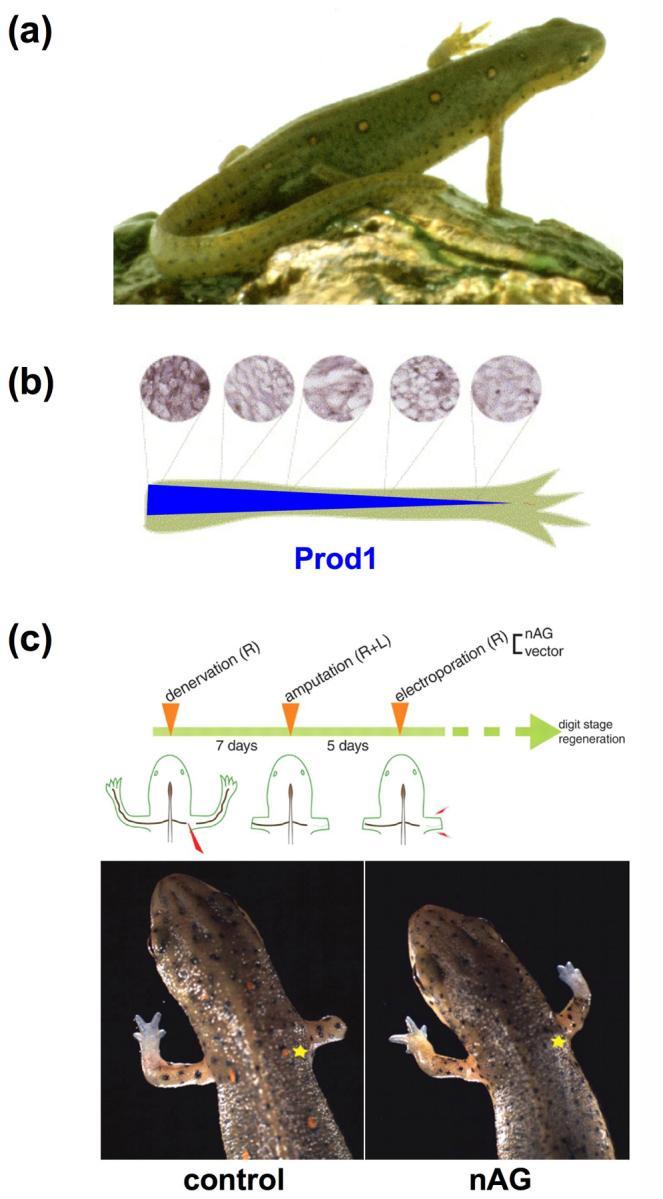
Regeneración de los miembros y el nervio de tritones dependientes de nAG. (a) Triton adulto regenera fielmente sus extremidades y la cola. (b) Prod1 es un receptor de superficie celular que se une a la proteína de gradiente anterior (nAG) del tritón y es expresada en un gradiente proximodistal en las extremidades tritón (arriba = manchas de anticuerpos para Prod1; abajo = gradiente de expresión Prod1 a lo largo de la vaina del nervio) . (c) (Arriba) procedimiento experimental para la electroporación de nAG en patas delanteras amputadas. (Abajo) Introducción de ADN complementario de nAG en condiciones de denervación del tejido y el patrón de proximodistal aproximado. (*, el sitio de la introducción del plásmido.)
Fuente:
-
Yin VP, Poss KD. New regulators of vertebrate appendage regeneration. Curr Opin Genet Dev. 2008 Aug;18(4):381-6. Epub 2008 Aug 11. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2574633/?tool=pubmed Abstract: Appendage regeneration is a complex and fascinating biological process exhibited in vertebrates by urodele amphibians and teleost fish. A current focus in the field is to identify new molecules that control formation and function of the regeneration blastema, a mass of proliferative mesenchyme that emerges after limb or fin amputation and serves as progenitor tissue for lost structures. Two studies published recently have illuminated new molecular regulators of blastemal proliferation. After amputation of a newt limb, the nerve sheath releases nAG, a blastemal mitogen that facilitates regeneration. In amputated zebrafish fins, regeneration is optimized through depletion of the microRNA miR-133, a mechanism that requires Fgf signaling. These discoveries establish research avenues that may impact the regenerative capacity of mammalian tissues.
Kenneth D. Poss - Department of Cell Biology, Duke University Medical Center, Durham, NC 27710, USA.
web: http://www.cellbio.duke.edu/Faculty/Research/Poss.html
e-mail: [email protected]


