El vedolizumab es el primer y único compuesto biológico aprobado para la colitis ulcerativa y la enfermedad de Crohn
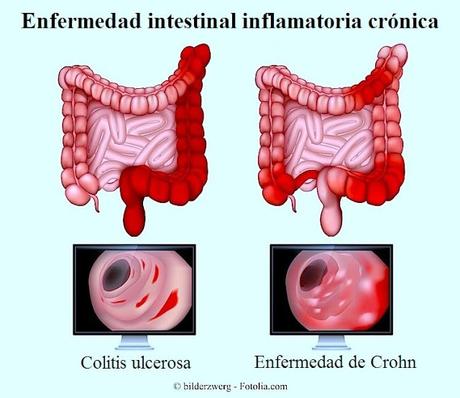 Quito, Abril de 2018.- Más de cuatro millones de personas en todo el mundo padecen alguno de los dos tipos de Enfermedad Inflamatoria Intestinal: colitis ulcerativa (CU) o la enfermedad de Crohn (EC).[i],[ii],[iii],[iv],[v],[vi]Aunque ambas patologías son incurables[vii],[viii],[ix]ya está disponible comercialmente en el Ecuador el anticuerpo monoclonal vedolizumab, el primer y único compuesto biológico aprobado para el tratamiento en pacientes adultos con CU y EC, de moderada a severa.A menudo la CU y la EC son diagnosticadas durante la edad adulta, ambas son enfermedades crónicas y debilitantes que los pacientes tienen que manejar durante la mayor parte de sus vidas.7,8 Estas patologías causan inflamación del revestimiento del tracto digestivo y por eso el objetivo de las opciones de tratamiento disponibles son inducir y mantener la remisión o atenuación de los síntomas, o alcanzar largos períodos en los que los pacientes no experimentan ninguna sintomatología.7,8“Obtener más información sobre la complejidad de estas enfermedades y continuar desarrollando nuevas opciones de tratamiento es de vital importancia debido a las necesidades y retos insatisfechos que estos pacientes siguen enfrentando, especialmente por la progresión de las patologías” mencionó Adolfo Saez, Director Médico de Takeda Ecuador & Perú y agregó que “la disponibilidad de vedolizumab como un tratamiento selectivo para el intestino es relevante para quienes sufren de colitis ulcerativa o de la enfermedad de Crohn en el país”.
Quito, Abril de 2018.- Más de cuatro millones de personas en todo el mundo padecen alguno de los dos tipos de Enfermedad Inflamatoria Intestinal: colitis ulcerativa (CU) o la enfermedad de Crohn (EC).[i],[ii],[iii],[iv],[v],[vi]Aunque ambas patologías son incurables[vii],[viii],[ix]ya está disponible comercialmente en el Ecuador el anticuerpo monoclonal vedolizumab, el primer y único compuesto biológico aprobado para el tratamiento en pacientes adultos con CU y EC, de moderada a severa.A menudo la CU y la EC son diagnosticadas durante la edad adulta, ambas son enfermedades crónicas y debilitantes que los pacientes tienen que manejar durante la mayor parte de sus vidas.7,8 Estas patologías causan inflamación del revestimiento del tracto digestivo y por eso el objetivo de las opciones de tratamiento disponibles son inducir y mantener la remisión o atenuación de los síntomas, o alcanzar largos períodos en los que los pacientes no experimentan ninguna sintomatología.7,8“Obtener más información sobre la complejidad de estas enfermedades y continuar desarrollando nuevas opciones de tratamiento es de vital importancia debido a las necesidades y retos insatisfechos que estos pacientes siguen enfrentando, especialmente por la progresión de las patologías” mencionó Adolfo Saez, Director Médico de Takeda Ecuador & Perú y agregó que “la disponibilidad de vedolizumab como un tratamiento selectivo para el intestino es relevante para quienes sufren de colitis ulcerativa o de la enfermedad de Crohn en el país”. La solicitud de autorización de comercialización de vedolizumab, como un agente biológico inmunosupresor selectivo para el intestino[x], fue apoyada por los Estudios GEMINI™, un programa clínico que comprende cuatro investigaciones de este compuesto en 2,700 pacientes en alrededor de 40 países. Es el mayor programa de ensayos clínicos de Fase 3 llevado a cabo simultáneamente que evalúa las poblaciones de personas con CU y EC,[xi],[xii],[xiii]que habían tenido una respuesta inadecuada, presentaron pérdida de respuesta o fueron intolerantes a por lo menos una terapia convencional, incluyendo corticosteroides, inmunomoduladores y/o antagonistas del factor de necrosis tumoral alfa (TNFα).“Para Takeda es muy satisfactorio poner a disposición el vedolizumab como una nueva opción de tratamiento para los médicos en el Perú, quienes trabajan incansablemente para ayudar a los pacientes a controlar la colitis ulcerativa y la enfermedad de Crohn”, dijo Martín Hernandez, Gerente General Ecuador & Perú, quien además explicó que la compañía “tiene una rica historia de compromiso con la comunidad global y está dedicada a quienes padecen estas patologías en todo el mundo".
Acerca de TakedaCon sede en Osaka, Japón, Takeda es una compañía farmacéutica global que invierte en investigación e innovación para comercializar más de 700 productos en 70 países, siendo especialmente fuerte en Asia, Norteamérica, Europa y Mercados Emergentes, incluyendo América Latina, Rusia-CIS y China. Fundada hace más de 235 años, es hoy una de las 15 mayores farmacéuticas del mundo y la número 1 en Japón, gracias al esfuerzo continuo de sus 31.000 colaboradores en la lucha para mejorar la salud y proporcionar un mundo más brillante a las personas en todo el mundo, por medio del liderazgo en la innovación de medicamentos. Con la integración de Millennium Pharmaceuticals y Nycomed, Takeda se ha transformado, aumentando su experiencia terapéutica y su alcance geográfico.
Para obtener más información, consulte la página web: https://www.takeda.com/
[i]Centers for Disease Control. Inflammatory bowel disease. http://www.cdc.gov/ibd/ Updated July 15, 2011. Accessed February 11, 2013. [ii]The Crohn’s and Colitis Foundation of Canada. The burden of inflammatory bowel disease (IBD) in Canada.http://www.isupportibd.ca/pdf/ccfc-ibd-impact-report-2012.pdf. Published November, 2012. Accessed February 11, 2013. [iii]Loftus EV Jr. Clinical epidemiology of inflammatory bowel disease: incidence, prevalence, and environmental influences. Gastroenterology. 2004;126(6):1504-1517. http://download.journals.elsevierhealth.com/pdfs/journals/0016-5085/PIIS0016508504004627.pdf. Accessed March 1, 2013. [iv]Wilson J, Hair C, Knight R Et al. High incidence of inflammatory bowel disease in Australia: a prospective population –based Australian incidence study. Inflamm Bowel Dis. 2010;16(9):1550-1556. [v]Asakura K, Nishiwaki Y, Inoue N, Hibi T, Watanabe M, Takebayashi T. Prevalence of ulcerative colitis and Crohn’s disease in Japan. J. Gastroenterol. 2009; 44:659-665. [vi]Sood A, Midha V, Sood N, Bhatia AS, Avasthi G. Incidence and prevalence of ulcerative colitis in Punjab, North India. Gut. 2003; 52:1587-1590. [vii]National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, National Digestive Diseases Information Clearinghouse. Crohn’s disease. http://digestive.niddk.nih.gov/ddiseases/pubs/crohns/index.aspx. Published December 2011. Accessed March 1, 2013. [viii]National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, National Digestive Diseases Information Clearinghouse. Ulcerative colitis. http://digestive.niddk.nih.gov/ddiseases/pubs/colitis/index.aspx Published October 2011. Accessed March 1, 2013. [ix]Knigge KL. Inflammatory bowel disease. Clin Cornerstone. 2002;4(4):49-60. [x]Entyvio Summary of Product Characteristics. January 2014. [xi]The Electronic Medicines Compendium. Remicade 100mg powder for concentrate for solution for infusion Summary of Product Characteristics. [xii]The Electronic Medicines Compendium. Humira Pre-filled Pen, Pre-filled Syringe and Vial Summary of Product Characteristics. http://www.medicines.org.uk/emc/medicine/21201/SPC/Humira+Pre-filled+Pen%2c+Pre-filled+Syringe+and+Vial. Updated December 4, 2012. Accessed February 13, 2013. [xiii]Data on File: Vedolizumab Integrated Summary of Safety.
