 Continuando con los fallos cometidos a la hora de formular, hoy os voy a hablar de la confusión que hay con el amoníaco y el amonio. Dos moléculas que aunque sus nombres sean parecido y sus fórmulas sean parecidas no son iguales.
Continuando con los fallos cometidos a la hora de formular, hoy os voy a hablar de la confusión que hay con el amoníaco y el amonio. Dos moléculas que aunque sus nombres sean parecido y sus fórmulas sean parecidas no son iguales.Cuando empezamos a aprender a formular compuestos inorgánicos, se ven los hidruros. Nos comentan que hay algunos que tienen nombre propio, como el caso del amoníaco cuya fórmula empírica es NH3.
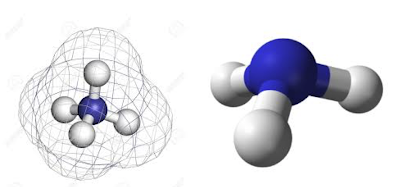
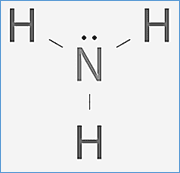 El amoníaco es una molécula que se utiliza para producir fertilizantes, en los productos de limpieza para el hogar y tiene aplicaciones industriales. Su geometría es piramidal, de 107,5º, polar y de hibridación entorno al átomo de N sp3.
El amoníaco es una molécula que se utiliza para producir fertilizantes, en los productos de limpieza para el hogar y tiene aplicaciones industriales. Su geometría es piramidal, de 107,5º, polar y de hibridación entorno al átomo de N sp3.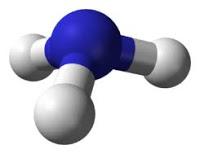 El aprendizaje de la formulación continua, y vemos los ácidos ternarios, oxisales … y llega un momento en el que nos enseñan a formular iones poliatómicos. Nos encontramos con que al igual que había hidruros con nombres propios, aparecen otros iones que también tienen nombres propios. Uno de ellos es el ión amonio (NH4+), que se forma por la protonación de amoníaco.
El aprendizaje de la formulación continua, y vemos los ácidos ternarios, oxisales … y llega un momento en el que nos enseñan a formular iones poliatómicos. Nos encontramos con que al igual que había hidruros con nombres propios, aparecen otros iones que también tienen nombres propios. Uno de ellos es el ión amonio (NH4+), que se forma por la protonación de amoníaco. 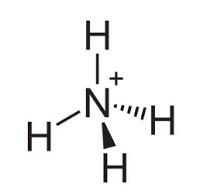 Sobre las aplicaciones del ión amonio puedo decir que no tiene aplicaciones en sí, pero sí que las tiene en forma de sales y otras moléculas derivadas del amonio. En la naturaleza hay moléculas derivadas del amonio como es el caso de los aminoácidos.
Sobre las aplicaciones del ión amonio puedo decir que no tiene aplicaciones en sí, pero sí que las tiene en forma de sales y otras moléculas derivadas del amonio. En la naturaleza hay moléculas derivadas del amonio como es el caso de los aminoácidos.Es una molécula tetraédrica, de 109,5º, polar, con hibridación alrededor del átomo de N sp3y que está cargada positivamente.
 Bibliografía:-www.chemicalsafetyfacts.org-www.educared.cu-Apuntes de 4º de la E.S.O y segundo de bachillerato Descubrirlaquimica. Estudiante de química en la USC. Exalumna del Colégio Sagrado Corazón de Pontevedra. Miembro SXGQ.24 de Agosto de 2019
Bibliografía:-www.chemicalsafetyfacts.org-www.educared.cu-Apuntes de 4º de la E.S.O y segundo de bachillerato Descubrirlaquimica. Estudiante de química en la USC. Exalumna del Colégio Sagrado Corazón de Pontevedra. Miembro SXGQ.24 de Agosto de 2019