El cobre (Cu) es un micronutriente esencial que necesitan las plantas y los microorganismos del suelo para su crecimiento. Sin embargo, puede resultar tóxico cuando se halla en exceso.
La toxicidad del cobre consiste en la formación de especies reactivas del oxígeno o bien es debida a su interacción con proteínas clave en procesos celulares, ya sea inactivando enzimas o alterando la estructura de las proteínas. A pesar de que el Cu es un elemento del que podemos encontrar únicamente trazas, se ha convertido recientemente en un problema para la agricultura y el medio ambiente.

Colonización del hongo en la
rizosfera de la planta.
Fuente: sdhydroponics
Durante años, venimos observando que las micorrizas en condiciones óptimas de crecimiento, crecen paralelamente a la planta, pero es en condiciones de estrés biótico (ataque por patógenos, herbívoros..) y abiótico (sequía, salinidad, metales pesados) cuando especialmente protegen a la planta (o a ellos mismos, recordemos que sin planta no hay micorriza) y la hacen más tolerante.
Centrándonos en los metales pesados, cuando hay un exceso en el suelo, las micorrizas son capaces de mejorar la toxicidad a estos en la planta. Sabemos que a partir de suelos contaminados con metales, se han aislado estos tipos de hongos y han demostrado tolerar mejor la exposición a metales que aquellos aislados de otros ambientes no contaminados. Pero ¿cuál es la estrategia que siguen?
Veamos. Planteemos dos experimentos:
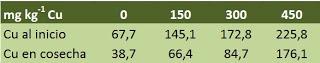
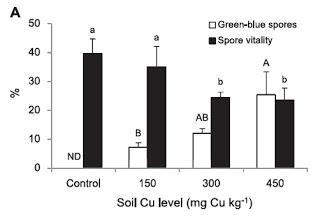
Experimento in vivoSe utiliza un suelo contaminado de cobre, concretamente con un contenido de 387 mg kg-1 Cu total. La muestra del suelo viene del Valle de Puchuncaví, en Chile. Para hacernos una idea, esta zona es de las más contaminadas de Chile hasta el punto que algunos expertos estiman en un período cercano a 500 años la recuperación de la zona. A este suelo se le añadió 0, 150, 300 o 450 mg kg-1 de Cu (CuCl2) y se dejó reposar 6 semanas. Posteriormente se sembraron plántulas de una especie de pasto llamado Imperata condensata inoculada previamente con uno de estos hongos micorrícicos, Claroideoglomus claroideum. Cuando analizaron el cobre que había en el suelo al inicio y en el momento de la cosecha, después de haber alojado a la planta-hongo, el resultado (os lo pongo gráficamente que se verá mejor) fue el siguiente:
Las esporas del hongo fueron aisladas del suelo por un procedimiento muy sencillo y ampliamente utilizado, y al ser analizadas bajo el microscopio, esto fue lo que se vio:
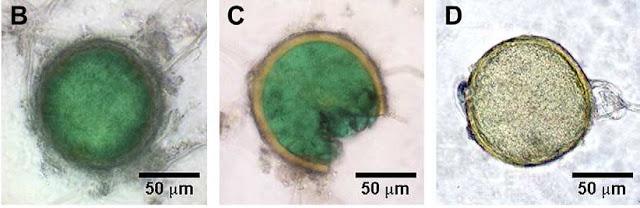
B,C. Esporas de C.claroideum aisladas del suelo donde se adicionó 450 mg Cu kg-1.
D. Espora del mismo hongo aislada del suelo control (0 mg Cu). Adaptado de Cornejo et al. (2012)
Experimento in vitroEn este post os he comentado que las micorrizas son biotrofos obligados y esto trae consigo un problema bastante gordo para los que hacemos biología molecular con ellos, y es la dificultad para hacerlos crecer en condiciones aisladas y estériles (más o menos, quiero decir) puesto que necesitan de la planta para vivir. Como ya expliqué, la solución, que llegó hace ya unos años (1996), bastante amoldada a ellos y a nosotros, es hacerlos crecer en una placa de Petri compartimentalizada donde en una mitad se coloca una raíz colonizada (esto es, con el hongo completamente establecido) y en la otra mitad nada. Después de darle las condiciones óptimas y esperar 3 meses, el micelio del hongo habrá conseguido "saltar" la barrera de la placa y podremos encontrarlo aislado (sin raíz de su planta asociada) en la otra mitad de la placa. ¿Me he explicado? Esta forma de hacer crecer al hongo se denomina cultivo monoxénico.
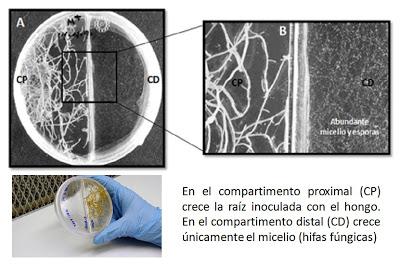
Una vez resuelto el problema del cultivo in vitro, volvamos al experimento.
En un compartimento se colocó raíz de zanahoria (comúnmente usada en el cultivo monoxénico) inoculada con Glomus intraradices DAOM 197198, ahora llamado Rhizophagus irregularis (debate eterno de los taxónomos que no se terminan de poner de acuerdo). Después de 2 semanas creciendo, se cambia el medio de cultivo y se pone otro medio fresco suplementado con 0, 5, 50 o 500 micromolar CuSO4. Al cabo de unos días, esto fue lo que se observó:
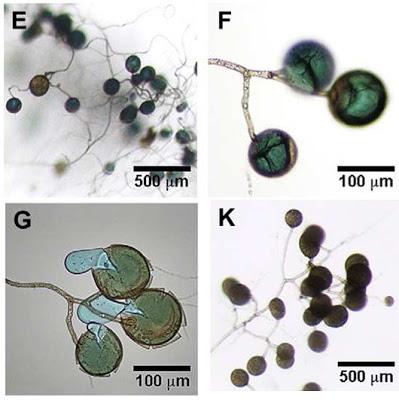
E-G. Esporas de R. irregularis crecidas en cultivo monoxénico 1 semana tras la adición de
500 micromolar de Cu al medio. K. Esporas del mismo hongo en medio control (sin Cu).
Adaptado de Cornejo et al. (2012)
Como podéis ver, el color verde azulado de las esporas de ambos experimentos fue debido a la acumulación de Cu dentro de la espora más que en la pared celular, como demuestra la figura G donde aparece una pérdida de contenido azulado. Según esta investigación, podría existir un mecanismo desconocido de "percepción de metales" en el hongo que traslocaría el metal de las hifas a las esporas (las hifas son las ramificaciones de las que salen las esporas y que se encargan de colonizar la raíz de la planta). En los hongos micorricicos-arbusculares, como en todos los organismos que disponen de una estrategia de compartimentalización intracelular para detoxificar contaminantes, el exceso de Cu sería transportado a compartimentos subcelulares y se almacenaría en estructuras fúngicas específicas donde el metal causaría menor daño.
Adaptado de Cornejo et al. (2012)
Por otro lado, las esporas obtenidas tanto del experimento in vivo como in vitro fueron sometidas a un análisis de su vitalidad para saber cómo afectaba la acumulación de Cu a su supervivencia. El resultado mostró que conforme se incrementa el nivel de cobre en el suelo (exp in vivo) o en el medio de cultivo (exp in vitro), disminuye la vitalidad de las esporas.
La novedad de este estudio radica en la descripción por primera vez mediante detección visual de esporas de hongos MA que acumulan Cu y la demostración de que estas esporas son metabólicamente inactivas. Estos datos sugieren que una de las estrategias de estos hongos para sobrevivir en medios contaminados con Cu es compartimentalizar el exceso de metal en algunas esporas.

Cornejo, P., Pérez-Tienda, J., Meier, S., Valderas, A., Borie, F., Azcón-Aguilar, C., & Ferrol, N. (2012). Copper compartmentalization in spores as a survival strategy of arbuscular mycorrhizal fungi in Cu-polluted environments Soil Biology and Biochemistry DOI: 10.1016/j.soilbio.2012.10.031NOTA 1: Este post participa en la XX Edición del Carnaval de Biología que en esta ocasión aloja @Multivac42 en su blog ForestaliaNOTA 2: También participa en la XXI Edición del Carnaval de Química que aloja @Ununcuadio en su blog Pero esta es otra historia...

