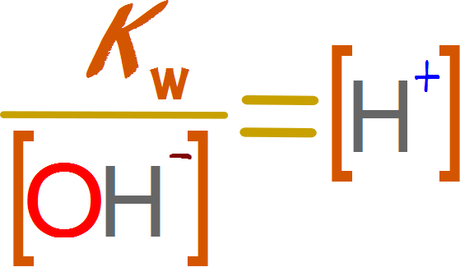 Calculando la concentración de iones
de la autodisociación del agua con un ácido fuerte y una base fuerte
Calculando la concentración de iones
de la autodisociación del agua con un ácido fuerte y una base fuerte
Calcular la concentración del ion hidronio y del ion hidroxilo 25°C en una solución de ácido nítrico al 0,15 molar y de hidróxido de calcio II al 0,01 M.
Análisis.
Se corrobora que las dos sustancias en cuestión NO sean electrolitos débiles, sea consultando la descripción de la sustancia o buscando en las tablas para las constates de disociación para la respectiva especie. En ejercicios como este generalmente se escribe que son electrolitos fuertes.
Una vez definido el tipo de electrolito observamos el tipo de especie química. Los ácidos se responden directo en base a los criterios descritos en el siguiente enlace.
Las bases deben analizarse, si capturan protones sin necesidad de electrolizarse se emplea el método descrito en el caso 1 en el siguiente enlace. Si por el contrario, la base involucrada proviene de la electrolisis como ocurre en los hidróxidos se emplea el método descrito en el caso 2 del siguiente enlace.
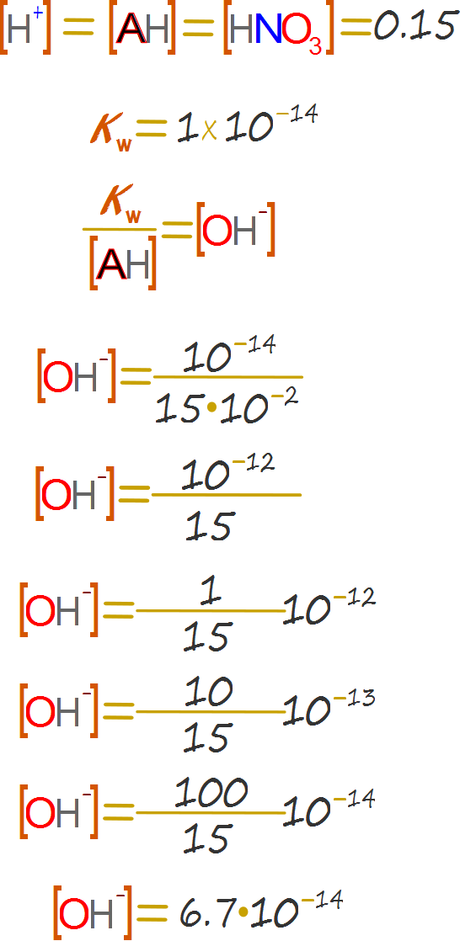
Solución del caso del ácido
0.01 Molar de ácido fuerte es muy superior a 10-7, por lo cual podemos emplear las ecuaciones (4) y (6) del caso 2.
Solución del caso del hidróxido.
El hidróxido libera una base fuerte. Del mismo modo libera más hidroxilos en comparación con los hidroxilos del agua. Emplearemos las ecuaciones (6) y (8) del caso 2 omitiendo los hidroxilos del agua. Sin embargo hay una modificación. El hidróxido del calcio 2 libera dos bases por cada unidad propia.
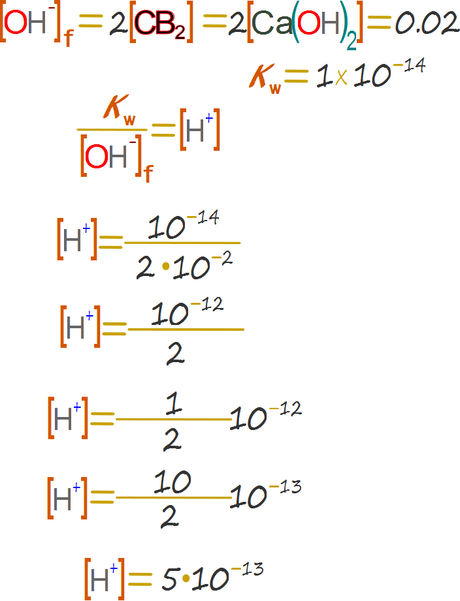 PRINCIPAL
REGRESAR
PRINCIPAL
REGRESAR
