
Calculando la constante de equilibrio, ejercicio de lápiz y papel
El ejercicio básico de lápiz y papel para el cálculo de la constante de equilibrio se lo puede visualizar como un ejercicio de estequiometria, de hecho la primer parte de un modelo de problemas estándar ya lo hemos trabajado en la siguiente sección (Enlace →). Bien, en el ejercicio anterior calculamos las concentraciones de todas las especies químicas en la mezcla de la reacción. En el presente problema simplemente es tomar estas cantidades, reemplazarlas en la expresión de la constante de equilibrio, resolver aritméticamente y obtener la constante y sus unidades.
La expresión de la constante de equilibrio, una vez deducida desde la reacción balanceada “tal como se muestra en estos ejercicios enlace→” puede emplearse para calcular la magnitud de la constante de equilibrio de la reacción bajo las condiciones termodinámicas específicas.
Por ejemplo, digamos que realizamos el proceso de metanación catalítica:
La composición de la mezcla de reacción una vez alcanza el equilibrio es de 0,613 moles de monóxido de carbono, 1,839 moles de hidrógeno molecular gaseoso, 0,387 moles de agua. La reacción se llevó a cabo en un reactor de 10 L.
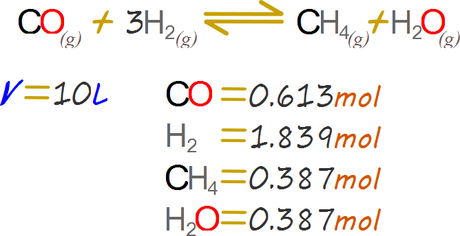
Este ejercicio puede ser abarcado mediante presiones parciales o mediante análogo de molaridad. Emplearemos en análogo de moralidad ya que es la unidad elegida por algunos libros de texto, sin embargo es importante resaltar que la definición de molaridad implica que el solvente es agua y no aire.
Obtenemos las concentraciones de cada una de las especies. Si se hace a mano se realiza del siguiente modo.

Sin embargo si se tienen muchos datos resulta más conveniente emplear tablas de Excel para calcular las magnitudes y solo resolver el ejercicio a mano para estar seguros de las unidades.
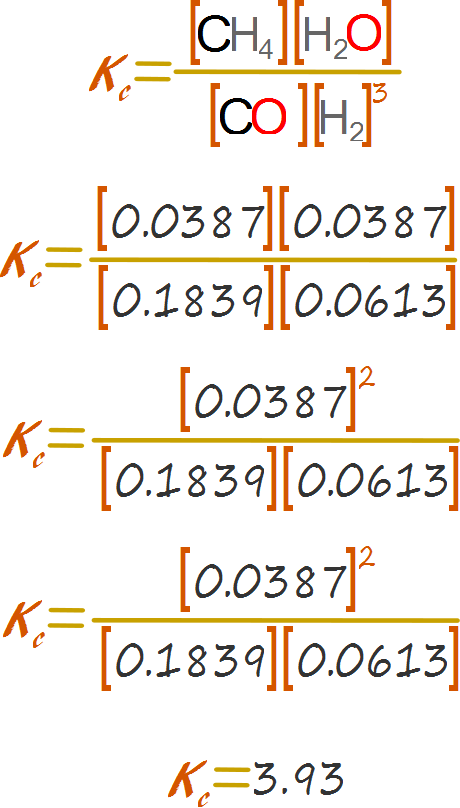
Una vez que se tienen los valores para las concentraciones, se reemplaza en la expresión de la constante de equilibrio y se calcula aritméticamente el valor de la constante de equilibrio.
PRINCIPAL REGRESAR
