
Entropía en química Introducción a la entropía química Microestados y entropía química Cambio de entropía de un sistema químico Entropia estandar La segunda ley de la termodinámica en términos matemáticos Entropía de la reacción y entropía del sistema Entropía de los alrededores Cambio de entropía de un sistema químico
Dado que la cantidad de microestados de equilibrio es mayor a la de los sistemas en desequilibrio “ordenados” la mejor metáfora que encontró Lord Kelvin para expresar el significado de la variable entropía era la del orden y desorden.
A medida que un sistema pasa de un punto en el tiempo a otro su conformación experimenta cambios hacia un estado más probable, de mayor equilibrio, eso en términos coloquiales implica un incremento en el desorden, ya que las posiciones en desorden pueden ser muchas y equivalentes entre sí, mientras que las posiciones del orden son pocas y no equivalentes entre sí.
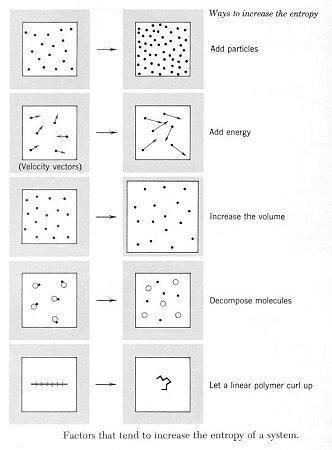
Figura CEQ-01. En este diagrama "de arriba hacia abajo" los tres primeros esquemas de cambio entrópico son físicos y tienen que ver con la ecuación de estado, en el primero se incrementa n, en el segundo se incrementa T y en el tercero se incrementa V disminuyendo P. El cuarto es un proceso de oxidación de macromoléculas y el último un cambio conformacional como los que experimentan las proteínas o el ARN; estos dos últimos cambios son cambios químicos. En todos los casos la entropia se incrementa hacia donde apunta la flecha.
Por ejemplo cuando se disuelve un cubo de azúcar en el agua obtenemos que el cubo de azúcar es una estructura altamente ordenada, la cual al disolverse se convierte en un conjunto de piezas desordenadas que cambian estructuralmente todo el tiempo, pero como todos esos cambios estructurales en el equilibrio son equivalentes entre si se los asimila como un conjunto desordenado. Aunque estadísticamente el cubo podría remotamente volver a formarse, esa probabilidad es infinitamente cercana a cero, alguien podría pasarse la eternidad del universo revolviendo un vaso de agua azucarada y no obtendría el orden de microestados que formaran el cubo nuevamente.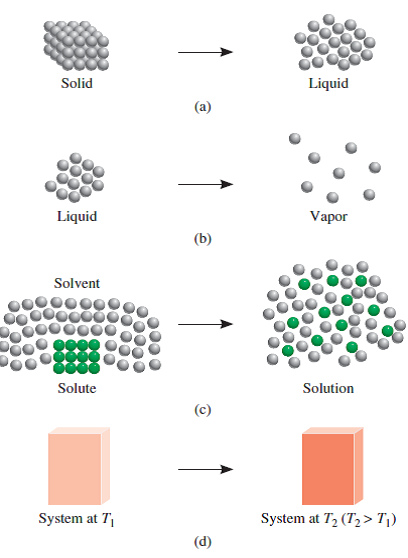
Figura CEQ-02. Similar a la figura 1 se nos muestran algunos cambios químicos en los que la entropia aumenta "de arriba para abajo": Cambio de fase sólida a líquida; cambio de fase líquida a gaseosa; proceso de solvatación y solubilidad; incremento de la temperatura y la vibración molecular.
Otra variable a tener en cuenta es la temperatura. La cantidad de microestados posibles de un sistema dependen de su vibración molecular, si las moléculas vibran poco podrán cambiar menos su conformación, lo que implica que la cantidad de microestados en ese punto será baja con respecto a otro estado con temperatura mayor, donde las moléculas se mueven más, y adquieren muchas más diferentes conformaciones. En otras palabras la temperatura es directamente proporcional a la entropía puesto que incrementa la cantidad de microestados posibles de un sistema. PRINCIPAL REGRESAR