 El comentario ganador es de Big Bang Científico. Muchas gracias por sugerir el tema.
El comentario ganador es de Big Bang Científico. Muchas gracias por sugerir el tema.Así que sin más, iniciemos.
El carbono 14 es el nombre popular (e incorrecto) dado a la técnica de fechamiento por radiocarbono. En realidad el carbono 14 es un isótopo radioactivo de carbono. La forma correcta de escribirlo es carbono-14. Entonces, una cosa es el carbono-14 (el isótopo radioactivo) y otra la técnica de radiocarbono. Hablemos primero del isótopo para entender la técnica.
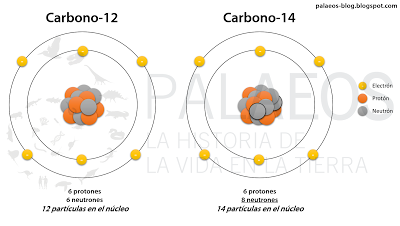 Carbono-12 (la forma estable natural más común de carbono) y la forma radioactiva, el carbono-14. Estos son isótopos (iso: mismo, topos: lugar, "mismo lugar en la tabla periódica"), formas atómicas que son similares en número atómico (número de protones y por ende de electrones) pero diferentes en masa atómica (generalmente por neutrones extra o "faltantes"). El número del isótopo se define por la masa que posee (que redondeada a número entero es similar al número de partículas en el núcleo).
Carbono-12 (la forma estable natural más común de carbono) y la forma radioactiva, el carbono-14. Estos son isótopos (iso: mismo, topos: lugar, "mismo lugar en la tabla periódica"), formas atómicas que son similares en número atómico (número de protones y por ende de electrones) pero diferentes en masa atómica (generalmente por neutrones extra o "faltantes"). El número del isótopo se define por la masa que posee (que redondeada a número entero es similar al número de partículas en el núcleo).Pero ¿de dónde viene el carbono-14? Bueno, generalmente (el 99.634% del tiempo) procede de átomos de nitrógeno-14 que están en la atmósfera (entre 9 y 15 Km de altura) y que son impactados por neutrones de alta energía (que proceden de átomos de hidrógeno y que son expulsados por culpa de los malvados rashos cósmicos). Estos neutrones (1 por átomo) son capaces de ingresar al núcleo de nitrógeno-14 y "expulsar" a uno de los protones de ahí (también 1 por átomo). Al cambiar el núcleo, ese átomo ya no se llama nitrógeno, pues su número de protones cambió de 7 a 6. Es decir, el pobrecillo núcleo no es capaz de mantener en órbita a siete electrones y sólo puede mantener a seis. Y un átomo que hace eso es llamado: carbono. Y este carbono tiene la peculiaridad de proceder de un nitrógeno más un neutrón metiche. Sumando las masas de estas partículas nucleares tenemos una masa atómica redondeada de 14, en vez del 12 común del carbono mundano, de ahí que reciba el poderoso nombre de carbono-14.
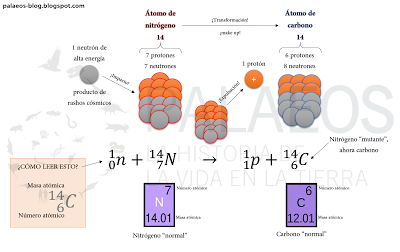 Diagrama para entender cómo surge el carbono-14. La fórmula del centro es nuestra guía, el cuadro naranja es para entender la fórmula por la masa atómica (masa combinada redondeada de neutrones y protones, cada uno vale una unidad) y el número atómico (cantidad de protones en el núcleo), los cuadros morados (crédito a Albedo-ukr) son el elemento en cuestión "ideal", el de la tabla periódica. Acá vemos lo que describo en el párrafo de arriba, el impacto de un neutrón de alta energía con un átomo de nitrógeno y su posterior transformación en carbono.
Diagrama para entender cómo surge el carbono-14. La fórmula del centro es nuestra guía, el cuadro naranja es para entender la fórmula por la masa atómica (masa combinada redondeada de neutrones y protones, cada uno vale una unidad) y el número atómico (cantidad de protones en el núcleo), los cuadros morados (crédito a Albedo-ukr) son el elemento en cuestión "ideal", el de la tabla periódica. Acá vemos lo que describo en el párrafo de arriba, el impacto de un neutrón de alta energía con un átomo de nitrógeno y su posterior transformación en carbono.Bien, ahora ya sabes de dónde viene el carbono-14. ¿Y a mi qué me importa ese tal carbono-14? Bueno, cuando se forman estos átomos, aproximadamente el 93% del tiempo reaccionan rápidamente con el oxígeno que ronda la vecindad y forma monóxido de carbono-14. Este monóxido se transforma después en dióxido de carbono-14 (CO2 con la peculiaridad de estar formado por un átomo de carbono-14 en vez del más abundante carbono-12). Luego (si recuerdan sus clases de biología), ese dióxido de carbono-14 es usado (junto con el resto de CO2) por las plantas (y otros fotosintéticos oxigénicos) como materia prima en la fotosíntesis. Una vez usado de esta forma, la planta hace sus trucos de magia (metabolismo) y fabrica azúcares que tienen como base el carbono, así como otras biomoléculas que ahora ¡sorpresa, sorpresa! Tienen carbono-14 en algunos lugares. Y si recuerdan las redes tróficas de la escuela, se darán cuenta que ese carbono-14 ha pasado de la atmósfera a las plantas y de ahí a los animales (y otros bichos come plantas), donde se integra para formar parte de los tejidos, de tal forma que todo cuanto vive tiene carbono-14 formando parte de ellos.
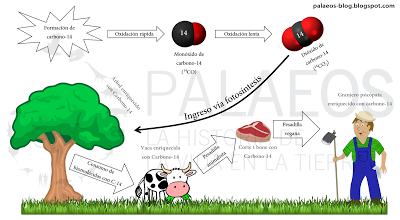 El "ciclo del carbono-14", de la tropósfera y estratósfera a tus tejidos, todos tus tejidos, recuerda: somos vida basada en el carbono.
El "ciclo del carbono-14", de la tropósfera y estratósfera a tus tejidos, todos tus tejidos, recuerda: somos vida basada en el carbono.Ahora, el carbono-14 ya está en todo tejido orgánico. Cabe aclarar que el carbono-14 es radioactivo. ¿Es entonces peligroso? Nah... que va. Hay distintos tipo de radiación y el buen C-14 emite una de las más inofensivas: radiación beta (es inofensiva porque es de baja energía y no pude producir alteraciones genéticas). Esta consiste en que uno de los protones del núcleo se transforma en un neutrón o viceversa. En este caso, el neutrón que ingresó y transformó al átomo de nitrógeno-14 en carbono-14 se transformará de vuelta en protón. Esto hace que la carga eléctrica del otrora carbono-14 se vuelva inestable (ahora hay una carga positiva extra) y el átomo vuelve a ser nitrógeno-14. Lo ejemplificaré en la siguiente imagen.
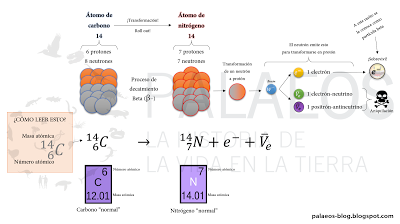 Proceso natural de decaimiento de carbono-14 a nitrógeno-14. Y si un neutrón de alta energía vuelve a impactar a ese pobrecillo nitrógeno-14, volveremos a tener carbono-14 (lo que convierte esto en un ciclo). Pero calma, que eso sólo ocurriría con nitrógeno atmosférico y como dije antes, entre 9 y 15 Km de altura. Abajo en morado se muestran las formas "normales" (isótopos estables más comunes) del carbono y nitrógeno. Por cierto el neutrón que se transforma en protón se queda en el núcleo, sólo el pequeño electrón emitido tras todo el desastre cuántico es liberado como partícula beta. Y es por eso que el carbono-14 no es cancerígeno, un electroncillo no puede hacer gran cosa (al menos no con esa baja energía).
Proceso natural de decaimiento de carbono-14 a nitrógeno-14. Y si un neutrón de alta energía vuelve a impactar a ese pobrecillo nitrógeno-14, volveremos a tener carbono-14 (lo que convierte esto en un ciclo). Pero calma, que eso sólo ocurriría con nitrógeno atmosférico y como dije antes, entre 9 y 15 Km de altura. Abajo en morado se muestran las formas "normales" (isótopos estables más comunes) del carbono y nitrógeno. Por cierto el neutrón que se transforma en protón se queda en el núcleo, sólo el pequeño electrón emitido tras todo el desastre cuántico es liberado como partícula beta. Y es por eso que el carbono-14 no es cancerígeno, un electroncillo no puede hacer gran cosa (al menos no con esa baja energía).Listo, ahora tenemos toda la información necesaria para entender cómo se forma el carbono-14 y cómo llega a nuestros tejidos. Si prestamos atención (especialmente en el gráfico del granjero loco), veremos que todos los seres vivos, de una forma u otra acaban con carbono-14 en sus tejidos (recordemos que somos vida basada en el carbono, nuestros ácidos nucleicos, proteínas, lípidos y carbohidratos tienen esqueletos de carbono). También notaremos que ese carbono se va "descomponiendo" (decayendo). Y el truco de la técnica de fechamiento por radiocarbono está en ese detalle: la tasa de decaimiento es constante y conocida.
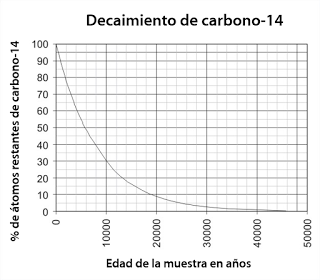 La tasa de decaimiento (proceso en el que un núcleo inestable se transforma en uno más estable) del carbono-14 es conocida y es invariable (al menos de forma natural). Esperamos que de una muestra del 100% de átomos de carbono-14 quede la mitad (50% de átomos de carbono-14) a los 5,730 años. A eso se le denomina vida media. Así que extrapolando, si medimos la cantidad de carbono-14 que queda en una muestra orgánica no alterada por procesos tafonómicos, seremos capaces de saber qué edad tiene. Figura original de Kurt Rosenkrantz, traducida por mi.
La tasa de decaimiento (proceso en el que un núcleo inestable se transforma en uno más estable) del carbono-14 es conocida y es invariable (al menos de forma natural). Esperamos que de una muestra del 100% de átomos de carbono-14 quede la mitad (50% de átomos de carbono-14) a los 5,730 años. A eso se le denomina vida media. Así que extrapolando, si medimos la cantidad de carbono-14 que queda en una muestra orgánica no alterada por procesos tafonómicos, seremos capaces de saber qué edad tiene. Figura original de Kurt Rosenkrantz, traducida por mi.¿Notaron algo en la curva de la imagen anterior? Pues que la curva se va haciendo cada vez más pequeña hacia los 50,000 años, hasta casi ser indetectable. Y es que pasada esa edad, la cantidad de átomos de carbono-14 restantes en la muestra es tan diminuta que nuestras poderosas máquinas no pueden detectarlo con precisión y por ende, el conteo tiene más y más rango de error. ¿Se puede fechar más allá de los 50,000 años? No sin un margen de error tan grande que nos arrojará fechas completamente erradas. Entonces es mejor usar otras técnicas de fechamiento.
 Los
Los Pero ¿cómo diantres cuentan los átomos de carbono-14? ¿Acaso alguien los mira en el microscopio? No, para nada. Para medir actualmente se utilizan contadores automatizados o semiautomatizados que están instalados en un espectrómetro donde se pueda hacer espectrometría de masas con aceleradores (AMS). Les explico en qué consiste en la siguiente figura.
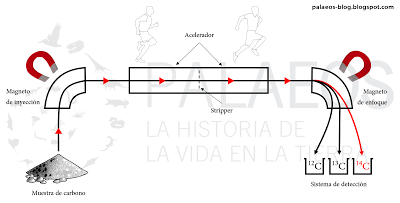 Forma muy simplificada de representar cómo funciona un espectrómetro de masas adaptado con un sistema para detección de isótopos de carbono. De forma simple, la muestra (tratada desde luego) se pone en una cámara donde se ionizan los átomos (se les da carga eléctrica), luego se inyectan en un flujo que pasa a un acelerador, donde un stripper
Forma muy simplificada de representar cómo funciona un espectrómetro de masas adaptado con un sistema para detección de isótopos de carbono. De forma simple, la muestra (tratada desde luego) se pone en una cámara donde se ionizan los átomos (se les da carga eléctrica), luego se inyectan en un flujo que pasa a un acelerador, donde un stripper Ok, entonces es el espectrómetro el que cuenta directamente la cantidad de isótopos de una muestra. ¿Y puede tener fallos? Claro, de hecho no hay aparato perfecto y todos tienen rangos de error conocidos. Esos se toman en cuenta cuando se arrojan las mediciones. Pero ¿cómo saben los científicos cuánto carbono-14 había en la muestra originalmente (el 100%) para de ahí saber cuánto carbono-14 queda en la muestra? O dicho de otra forma, si no sabes cuánto dinero metiste originalmente en tu bolsillo roto del pantalón y ahora te encuentras sólo un puñado de monedas ¿cómo sabes cuánto dinero perdiste? Con el radiocarbono, eso es muy importante: saber cuánto carbono-14 había originalmente en la muestra para poder conocer cuánto nos queda luego del decaimiento natural del isótopo radioactivo y con esa información estimar la edad de la muestra. La respuesta no es mágica, es científica: el carbono-14 se produce y asimila de forma constante y dependiendo del tipo de tejido, tendremos diferentes proporciones de carbono-14 en las biomoléculas. A este fenómeno se le denomina enriquecimiento isotópico. Además del tipo de tejido, hay otros factores (metabolismo, altitud, latitud, etc.) que modifican la cantidad de carbono-14 en una biomolécula, a este fenómeno se le denomina fraccionamiento isotópico. Y estos fenómenos son conocidos y tomados en cuenta cuando se estima una edad.
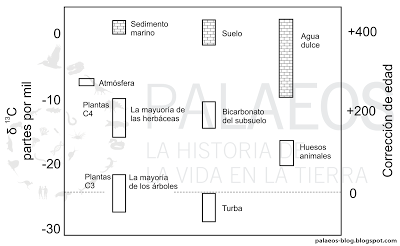 Algunos valores conocidos de fraccionamiento isotópico de carbono-14. La delta de carbono-13 no indica que se está midiendo ese isótopo, sino la diferencia entre éste y el 14 (eso significan las deltas). Las barras marcadas con ladrillos corresponden a carbonatos en sedimento marino, suelo y agua dulce. Del lado derecho vemos la corrección que se tiene que hacer para calcular una edad adecuada. Basado en Mook y Streurman (1983).
Algunos valores conocidos de fraccionamiento isotópico de carbono-14. La delta de carbono-13 no indica que se está midiendo ese isótopo, sino la diferencia entre éste y el 14 (eso significan las deltas). Las barras marcadas con ladrillos corresponden a carbonatos en sedimento marino, suelo y agua dulce. Del lado derecho vemos la corrección que se tiene que hacer para calcular una edad adecuada. Basado en Mook y Streurman (1983).Como viste anteriormente, varios
 Menuda cantidad de sinsentidos tiene este escrito creacionista, pero bueno, todo sea por "vender" una idea falsa. Si quieren torturar su vista y mente, pueden entrar al link de donde saqué menuda montaña de porquería.
Menuda cantidad de sinsentidos tiene este escrito creacionista, pero bueno, todo sea por "vender" una idea falsa. Si quieren torturar su vista y mente, pueden entrar al link de donde saqué menuda montaña de porquería.¿No te convence? Ok, supongamos que tenemos buena fe (pun intended hehe) que sí extrajimos carbono original de una muestra cuasi milagrosa (hehe) de colágeno intacto de dinosaurio (hay algunas muestras que valen la pena consideración como las de células, ADN y biomoléculas descubiertas realmente) y lo mandamos analizar ¿nos dará su edad? No. La respuesta está en la tasa de decaimiento de carbono-14, pues de una muestra del 100% esperamos que para los 91,680 años sólo tengamos en la muestra 0.00015% carbono-14. Y si quisiéramos tener la cantidad de muestra para calcular esos 91 mil años, deberíamos meter en el pobre espectrómetro la maravillosa cantidad de 6,250 kilogramos de colágeno (ni imaginar la cantidad de huesos que habría que pulverizar para obtener esa cantidad) para poder obtener la edad sin errores mayúsculos. ¿Cómo carajos esperan los creacionistas obtener edades superiores al millón de años si es prácticamente imposible hacerlo con "sólo" 91 mil años? Pues esa es su agenda, tratan de engañar a la gente diciéndoles que los dinosaurios sólo vivieron hace unos miles de años e incluso, les han negado hacer sus análisis fraudulentos para que los laboratorios no pierdan prestigio (clic aquí para ver una carta de rechazo a su agenda).
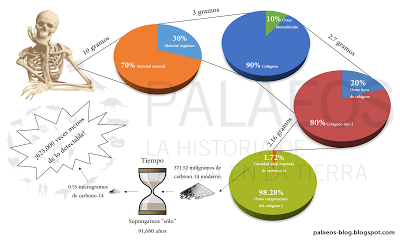 Medir la cantidad de carbono-14 restante en una muestra no es cualquier cosa, pues hay que tomar en cuenta que no toda la muestra presenta la completitud de su integridad orgánica y casi siempre se recupera mucho menos de los 2.16 gramos de colágeno I para analizar (según este ejemplo). La cosa es que si "sólo" queremos estimar la edad de una muestra que ronde los 91 mil años ("sólo" 44 mil años más de lo que garantizan los laboratorios) necesitaremos una máquina 625,000 veces más potente que las que ya tenemos. De tal forma que si queremos usar una máquina moderna y tenemos condiciones ideales, deberíamos introducir 6.25 toneladas de colágeno extraído de huesos fósiles de la misma edad (algo que de por sí es un lío garantizar) al pobre espectrómetro. Para que se hagan una idea, la cantidad real que piden los laboratorios es de 1 a 4 gramos de hueso.
Medir la cantidad de carbono-14 restante en una muestra no es cualquier cosa, pues hay que tomar en cuenta que no toda la muestra presenta la completitud de su integridad orgánica y casi siempre se recupera mucho menos de los 2.16 gramos de colágeno I para analizar (según este ejemplo). La cosa es que si "sólo" queremos estimar la edad de una muestra que ronde los 91 mil años ("sólo" 44 mil años más de lo que garantizan los laboratorios) necesitaremos una máquina 625,000 veces más potente que las que ya tenemos. De tal forma que si queremos usar una máquina moderna y tenemos condiciones ideales, deberíamos introducir 6.25 toneladas de colágeno extraído de huesos fósiles de la misma edad (algo que de por sí es un lío garantizar) al pobre espectrómetro. Para que se hagan una idea, la cantidad real que piden los laboratorios es de 1 a 4 gramos de hueso.De tal forma que llevar a cabo análisis de radiocarbono con restos que ya sabemos tienen más de 50,000 años de antigüedad es perder el tiempo (y dinero). Así que si te quieren ver la cara diciendo que hay evidencia de que existen dinosaurios más jóvenes de 50,000 años (muchos laboratorios comerciales sólo ofrecen confiabilidad hasta los 47,000 años), ya sabes que se trata de timadores. Hay forma de saber edades más viejas, lo máximo fechado con radiocarbono es de más de 70,000 años, pero bajo condiciones muy especiales y tratamientos únicos, costosos y con riesgo de contaminación isotópica. Es por ello que prácticamente no se hacen. Si queremos conocer fechas más antiguas, recurrimos al uso de isótopos con vidas medias más largas y muestras de distinta naturaleza química y genética.
 Fraude, fraude apestoso y horrendo.
Fraude, fraude apestoso y horrendo.Volviendo al tema del radiocarbono, las fechas obtenidas por el espectrómetro y el análisis del carbono-14 y los otros isótopos de carbono son fechas crudas, les falta algo. Ese algo es lo que se denomina calibración. La calibración se lleva a cabo comparando con objetos de edades conocidas, específicamente madera de árboles de metabolismo C3. Posteriormente, se usaron otros materiales y objetos como los corales, las espeleotermas y una gran variedad de sedimentos que se fecharon en espacios de 4 a 5 años. Una vez obtenida la calibración, es posible comparar nuestros datos de edad con otros datos de edades obtenidas por otros equipos de investigación. Cosa importante de mencionar es que existe un grupo de expertos que constantemente verifica las calibraciones, a ese grupo se le conoce como IntCal (clic aquí para ir a una página del calibración y aquí para acceder a la base de datos) y posee una base de datos consultable y actualizada de datos de calibración.
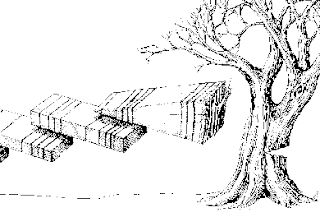 El fechamiento de los anillos de los árboles con edades conocidas fue el primer método para poder calibrar las curvas de radiocarbono. En un momento llegaremos a esa parte. Imagen tomada de este sitio.
El fechamiento de los anillos de los árboles con edades conocidas fue el primer método para poder calibrar las curvas de radiocarbono. En un momento llegaremos a esa parte. Imagen tomada de este sitio.¿Y para qué calibrar? Bueno, porque no es lo mismo años radiocarbónicos que años calendáricos. Entonces, si no calibramos, no tendremos ni la más remota idea de a qué nos referimos cuando decimos que tales o cuales restos tienen 32,000 años de antigüedad. Ajá, 32 mil años, ¿antes de qué? ¡Pues del presente desde luego! Pero ¿y si quiero comparar un estudio del año más bonito del mundo, 1986 contra un estudio hecho hoy? ¿Le quito 30 hermosos años? ¿O cómo le hago? Bueno, esto es la pregunta clave del fechamiento ¿qué ch#$%&s es el presente? Actualmente definimos el presente como 1950. Ese es el "año 0" científico y es porque los fechamientos por radiocarbono se hicieron posibles en esa fecha y porque también a partir de esa fecha, la industria y las detonaciones nucleares han alterado la proporción de nitrógeno-14 y carbono-14 atmosférico, alterando también su fraccionamiento en tejidos vivos. O sea, si medimos algo que sea posterior a 1950 obtendremos fechas muy raras. De ahí que de nuevo, los creacionistas recurran a decir que el radiocarbono no es confiable porque una almeja moderna da como resultado que tiene 300 años muerta.
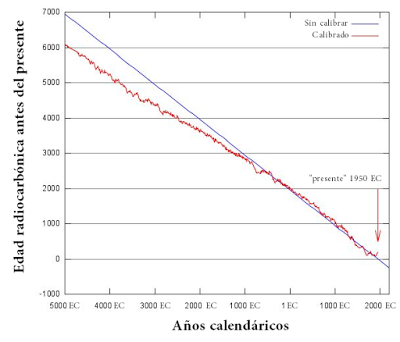 Curva calibrada de edades, donde vemos que el "presente" inicia en 1950 y que los años sin calibrar (azules) no son iguales a los años calibrados (rojo). EC: era común. Este post se publicó en el 2016 de la EC. Figura modificada de este sitio.
Curva calibrada de edades, donde vemos que el "presente" inicia en 1950 y que los años sin calibrar (azules) no son iguales a los años calibrados (rojo). EC: era común. Este post se publicó en el 2016 de la EC. Figura modificada de este sitio.Y es bajo todas éstas consideraciones (y unas cuantas más que no puse) que se lleva a cabo la técnica de radiocarbono. Así que ya lo saben, cuando vean una fecha radiocarbónica en un paper, saben que detrás de ella hay un análisis sesudo y el trabajo de mucha, mucha gente. Las cosas no son tan simplonas como lo hacen ver algunos "negadores de la antigüedad de la tierra" o cualquier otro de sus elementos como los dinosaurios no avianos. Así que recapitulemos los puntos importantes:
- Carbono-14 es un isótopo radioactivo, radiocarbono la técnica de fechamiento usando ese isótopo.
- El carbono-14 se produce de forma natural en las partes altas de la atmósfera a partir de nitrógeno-14.
- El carbono-14 ingresa a los ecosistemas como parte del ciclo natural del carbono.
- El carbono-14 ingresa a los sistemas vivos por medio de la fotosíntesis y las redes tróficas.
- Todos los seres vivos tienen carbono-14 como parte integral de sus biomoléculas.
- La cantidad de carbono-14 en los tejidos disminuye con el tiempo por su decaimiento a nitrógeno-14.
- La tasa de decaimiento en carbono-14 es fija, con una vida media de 5,730 años.
- La cantidad de carbono-14 en una muestra orgánica disminuye conforme pasa el tiempo de forma exponencial, entre más vieja la muestra, menos carbono-14 contiene.
- Para medir la cantidad de carbono-14 en una muestra se usa un espectrómetro de masas y la técnica de aceleración de masas, inducida por magnetismo.
- Para que la medición tenga sentido debemos saber la cantidad de carbono-14 inicial presente en una muestra.
- La cantidad inicial de carbono-14 es conocida para muchos tejidos orgánicos y son éste tipo de tejido (y no cualquiera) el que se analiza.
- La cantidad de carbono-14 que pueden detectar nuestros espectrómetros es limitada, por lo que la técnica casi nunca se usa cuando se sospecha que la muestra tiene más de 50,000 años.
- Por ende, NUNCA se ha usado, ni se usará radiocarbono para fechar cosas más antiguas al Pleistoceno tardío terminal (>50,000 años).
- La fecha obtenida con radiocarbono se tiene que calibrar para darle sentido al cálculo y poder ser comparable.
El radiocarbono es una técnica eficaz y confiable para obtener la edad de restos orgánicos que no superen los 50,000 años de antigüedad. Desde su primer uso, ha demostrado tener la capacidad de aportar información valiosísima acerca de diferentes aspectos acerca de la fundación de la época reciente y los cambios que le dieron forma al mundo. Por ello, es muy importante que por lo menos se conozca esta técnica de forma superficial (como la aquí presentada), pues nos ayuda a responder grandes preguntas que de otro modo serían mucho más difíciles de responder.
Espero que el tema te haya gustado. Si es así ayúdame compartiéndolo en tus redes sociales. Que tengas un excelente día.
Literatura consultada:
Jull, A. J. T. y G. S. Burr. (2015). Radiocarbon dating. En: Rink, W. J. y ThompsonJ. W. (Eds.). Encyclopedia of Scientific Dating Methods. Dordrecht: Springer Netherlands. 669-679.
Mook, W. G., & Streurman, H. J. (1983). Physical and chemical aspects of radiocarbon dating. In Proceedings of the First International Symposium 14 C and Archaeology, Groningen, 1981 (Vol. 8, pp. 31-55). Council of Europe.
Wigley, T. M. L. y A. B. Muller. (1981) Fractionation corrections in radiocarbon dating. Radiocarbon. 23(2): 173-190.

