 Ceder protones y
aceptar protones, teoría de Bronsted-lowry
Ceder protones y
aceptar protones, teoría de Bronsted-lowry
Como se dijo anteriormente, la teoría de Arrhenius para los ácidos y las bases se basaba en la disociación iónica del agua más a la adición de otra especie que alterara su equilibrio. De esta forma si la solución contenía una gran cantidad de grupos hidronio se decía que era ácida, mientras que si contenía una gran cantidad de grupos hidroxilo se decía que era básica.
La definición de Arrhenius depende del agua como solvente, por lo que es difícil identificar una reacción acido base en otros solventes o en ausencia de un solvente líquido.
En 1923el químico danés Johannes N. Brønsted (1879–1947) y de manera independiente el químico inglés Thomas M. Lowry (1874–1936) propusieron un nuevo modo de entender los ácidos y las bases.
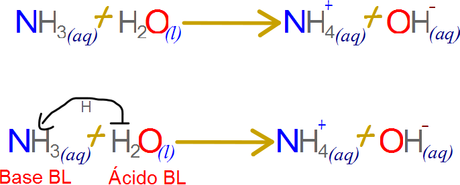
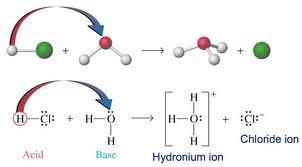
Aunque en la teoría de Bronsted-Lowry el protón sigue siendo el portador de la acidez esta vez lo hace con independencia a la formación del ion hidrónio. El concepto de base se resignifica, ahora cualquier aceptor de protones es una base por lo que las peculiares reacciones del amoniaco ingresan perfectamente en el marco conceptual.
Aunque en muchos libros de texto se dice que es una teoría más amplia vale la pena anotar que resignifica completamente el concepto de ácido y base. Por lo general muchas de las experiencias de laboratorio así como el concepto de pH pueden entenderse en términos de esta teoría de ácidos y bases, pues de hecho es la que más se emplea en la biología.En cualquier caso las definiciones:
Un ácido de Bronsted-Lowry se define como una sustancia que dona protones, en este caso el receptor nos importa un comino. Es decir pueden formarse iones hidrogeniones o puede que no, eso depende del tipo de base presente en la reacción.
Una base de Bronsted-Lowry es un aceptor de protones, este concepto libera a las reacciones ácido base del solvente agua, y también de la especie química hidroxilo. En base a la definición de Bronsted-Lowry, aunque el grupo hidroxilo es una buena base al ser un fuerte aceptor de protones, no es la única, también está el agua que forma iones hidronio, y el amoniaco para formar iones amonio, y así sucesivamente con cualquier especie química capaz de capturar protones. PRINCIPAL REGRESAR
