 Reacciones ácido base
Teoría de Bronsted Lowry de ácidos y bases
El concepto de pH y la medida de la acidez
La Autoionización del agua
La constante de disociación del agua Kw
Una advertencia, la diferencia de un electrolito fuerte y
uno débil
Soluciones con un ácido fuerte y su efecto en la
autoionización del agua
Soluciones con una base fuerte y su efecto en la
autoionización del agua
Calculando la concentración de iones de la autodisociación
del agua con un ácido fuerte
Cuantificación de la acidez, la basicidad y la neutralidad
El pH de una solución
Calculando el pH de una solución
Utilidad del concepto de pH en los sistemas biológicos
¿Cómo determinar el pH de una solución?
Ejercicios sobre el PH de una solución
Reacciones ácido base
Teoría de Bronsted Lowry de ácidos y bases
El concepto de pH y la medida de la acidez
La Autoionización del agua
La constante de disociación del agua Kw
Una advertencia, la diferencia de un electrolito fuerte y
uno débil
Soluciones con un ácido fuerte y su efecto en la
autoionización del agua
Soluciones con una base fuerte y su efecto en la
autoionización del agua
Calculando la concentración de iones de la autodisociación
del agua con un ácido fuerte
Cuantificación de la acidez, la basicidad y la neutralidad
El pH de una solución
Calculando el pH de una solución
Utilidad del concepto de pH en los sistemas biológicos
¿Cómo determinar el pH de una solución?
Ejercicios sobre el PH de una solución
¿Cómo determinar el pH de una solución?
El pH de una solución puede determinarse mediante una gran variedad de métodos. Si hablamos de una determinación cualitativa se pueden emplear indicadores, como en el caso del papel tornasol.
En cuanto a la determinación cuantitativa actualmente los laboratorios de química muy básica de cualquier colegio deberían al menos contar con la posibilidad del análisis volumétrico por titulación, y de la determinación con un pHmetro.
El análisis volumétrico es más engorroso, pero sin duda permite implementar una enorme variedad de conceptos además de ser más experimental. En temas posteriores estudiaremos con detenimiento esta práctica de laboratorio tan común en los primeros semestres que las carreras de química y ciencias relacionadas.
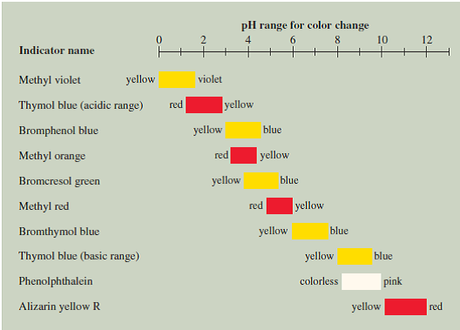
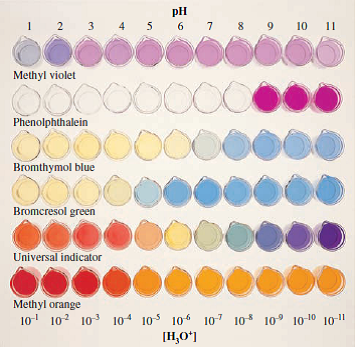
Figura DpH-01. Algunos colorantes indicadores empleados frecuentemente en las practicas de laboratorio.
En cualquier caso el análisis volumétrico emplea un colorante indicador que cambia de color cuando una solución alcanza un pH determinado. Este punto de control es el que permite determinar la concentración de iones hidrogeniones.
El PH metro es más directo, siendo una máquina que al ser calibrada con dos soluciones amortiguadoras puede arrojar el valor de pH muy cercano sin tantos problemas. PRINCIPAL REGRESAR
