Hola descubridores de la química,
Anteriormente he escrito dos entradas sobre el concepto de ácido y de base. En una lo hacía desde el punto de vista de la teoría de Brönsted y en otra lo hacía desde el punto de vista de la teoría de Lewis. Pero lo cierto es que estas teorías es muy fácil confundirlas.
Para tratar de solucionarlo retomaremos la línea ¡Ojo, no falles! Del blog. Abriremos un nuevo tipo de fallos en química, los fallos conceptuales, en los cuales incluiremos este.
¿Por qué es fácil confundir las teorías? Porque hablan de ceder y aceptar. Y una dice lo contrario que la otra. Pero fíjate, la teoría de Brönsted habla de protones (H+ que tienen carga positiva) y la teoría de Lewis habla de densidad electrónica (los electrones tienen carga negativa).
Es necesario saber de lo que se habla para poder aplicar la teoría correspondiente. Aunque hay reglas nemotécnicas que nos permiten recordar que era lo que decía la teoría. La teoría de Brönsted es el juego vocal-consonante, ya que un ácido cede protones y una base acepta protones. La teoría de Lewis es el juego vocal-vocal, consonante-consonante, ya que el ácido acepta densidad electrónica y la base cede densidad electrónica.
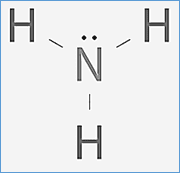
Además, sabemos que lo que dice la teoría de Brönsted tiene que ser justificado y llegándose a la misma conclusión con la teoría de Lewis. Si analizamos el ejemplo típico de base que es el amoníaco (NH3) y dibujamos su estructura de Lewis veremos que tiene un par solitario a través del que puede compartir densidad electrónica, además puede captar un protón convirtiéndose en amonio (NH4+).
 Descubrirlaquimica. Estudiante de Química en la USC. Exalumna Colégio Sagrado Corazón de Pontevedra. Miembro SXGQ 21 de Septiembre de 2019
Descubrirlaquimica. Estudiante de Química en la USC. Exalumna Colégio Sagrado Corazón de Pontevedra. Miembro SXGQ 21 de Septiembre de 2019