 Cuantificación de la acidez, la
basicidad y la neutralidad
Cuantificación de la acidez, la
basicidad y la neutralidad
En base a la auto-disociación del agua que dio origen a la teoría de Arrhenius, la acidez es la medida de iones hidrogeniones y la basicidad la medida de los iones hidroxilo. Una solución neutra es aquella en que las dos especies iónicas representan una concentración exacta de 10-7.
En base a la teoría de Bronted-Lowry mandamos al demonio a los iones hidroxilo y todo lo definiremos en base única y exclusivamente de los protones cedidos a la solución acuosa que forma iones hidrogeniones.
Así una solución básica es aquella que posee una concentración de protones cedidos y una formación de iones hidrogeniones equivalente a 10-7- Una solución ácida implica el incremento de la concentración de iones hidrogeniones, por lo que el valor del exponente negativo disminuye a medida que la concentración aumenta. Por ejemplo 0.01 = 10-2 > 0.0001=10-4, la magnitud del número es inversamente proporcional al valor del exponente si este es antecedido por un negativo.
Del mismo modo una solución se hace más básica a medida que los iones hidrogeniones disminuye, lo que incrementa el valor del exponente negativo a medida que el número de hace más pequeño
Por lo anterior podemos resumir del siguiente modo
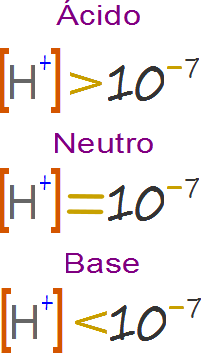
Los ácidos tienen concentraciones de hidrogeniones con exponentes de 10-6, 10-5, 10-4…10-1, 10, 1
Los ácidos tienen concentraciones de hidrogeniones con exponentes de 10-8, 10-9, 10-10…10-14 PRINCIPAL REGRESAR
