 Ronnie James Dio es conocido por popularizar la señal de los cuernos dentro del Heavy Metal. Su abuela, que era italiana, lo usaba para protegerse del mal de ojo o malocchio. Dio comenzó a utilizar el signo poco después de unirse a la banda Black Sabbath. Ozzy Osbourne, su antecesor en la banda, era conocido por el uso del signo de la victoria o de la paz (elevar el dedo índice y corazón en forma de V) en sus actuaciones. Dio, en un intento de contactar con los fans de la banda, y no queriendo imitar a Ozzy comenzó a utilizar el signo de que su abuela hacía siempre. El signo mas tarde se lo apropiaron los fans del Heavy Metal con el nombre de "Maloik", derivado del malocchio (nombre italiano del "mal de ojo" que hacía su abuela).
Ronnie James Dio es conocido por popularizar la señal de los cuernos dentro del Heavy Metal. Su abuela, que era italiana, lo usaba para protegerse del mal de ojo o malocchio. Dio comenzó a utilizar el signo poco después de unirse a la banda Black Sabbath. Ozzy Osbourne, su antecesor en la banda, era conocido por el uso del signo de la victoria o de la paz (elevar el dedo índice y corazón en forma de V) en sus actuaciones. Dio, en un intento de contactar con los fans de la banda, y no queriendo imitar a Ozzy comenzó a utilizar el signo de que su abuela hacía siempre. El signo mas tarde se lo apropiaron los fans del Heavy Metal con el nombre de "Maloik", derivado del malocchio (nombre italiano del "mal de ojo" que hacía su abuela).
Dejando de lado la historia del Heavy Metal, lo cierto que este símbolo, satánico para algunos, tiene que ver con la química. Según cuentan, hay una historia famosa en la Universidad de Cambridge sobre un alumno que aisló CrO 5 sólido en gran cantidad. Cuando otro profesor lo estaba agitando en un tubo de ensayo el CrO 5 explotó y el chico perdió los dedos corazón y anular.
¿Qué es el CrO5 y cómo se forma?

Los compuestos más conocidos de este metal son los cromatos, en los que el cromo ha perdido sus 6 electrones de la ultima capa [Cr(VI)]. Son compuestos tetraédricos donde los oxígenos se encuentran en los extremos de un tetraedro y el cromo en el centro. Son compuestos muy oxidantes, reduciéndose el cromo a [Cr (III)], que es octaédrico.
Cuando hacemos reaccionar cromato sódico con peróxido de hidrógeno en medio ácido se forma un compuesto azul intenso con formula CrO 5 , según la reacción:
¿Qué estructura tiene?
Pero, ¿cómo puede tener el cromo valencia +10?. Para averiguarlo (y entenderlo) habría que escribir el compuesto de otra manera, como CrO(O 2)2 , es decir, es un oxoperóxido de cromo (VI), con una estructura de pirámide de base cuadrada (donde se encuentran los grupos peróxido en la base y en la punta el grupo oxo).
Esta estructura es tremendamente inestable. Y como ya sabemos, en química, inestable significa generalmente explosivo (los productos de reacción son mucho más estables que los de partida), y basta un simple roce o palmada para hacer explotar al compuesto (si se encuentra en cantidad apreciable y seco). El compuesto en si es inestable por diversas razones. Parte de esta inestabilidad se la confiere el ligando peroxo. Este ligando es angular, pero en el compuesto CrOespués de unos segundos, el CrOPara evitar esta autodescomposición (el cromo se reduce y el peróxido se oxida), es posible estabilizar el CrO 5 se encuentra muy tensionado (el cromo y los dos oxígenos del peróxido forman un triangulo, por lo que están en el mismo plano). Además, dentro de la molécula hay unos átomos que se pueden reducir y otros que se pueden oxidar (es una molécula anfótera), por lo que no necesita ningún otro compuesto para autoreaccionar. Por suerte, d 5 se descompone para dar compuestos de cromo (III), de color verde. 5 en un disolvente orgánico inmiscible en agua, como por ejemplo dietiléter, acetato de amilo, piridina, 1-butanol, etc. formándose un compuesto CrO(O 2)2-py (si usamos piridina como disolvente) un poco más estable que en la fase acuosa. Veamos por que se estabiliza:
¿Cómo estabilizamos el CrO5?
Este compuesto tiene una estructura aproximada de pirámide de base pentagonal. Antes de pasar a más detalles, miremos como es el compuesto de partida y el compuesto los compuestos de partida
El Cr(VI) en su forma de cromato tiene una estructura tetraédrica con los oxígenos en los vértices del un tetraedro. El átomo de cromo se encuentra con hibridación sd 3, quedando los orbitales más estables en un entorno tetraédrico (dx 2-y 2 y dz 2) sin hibridar (se hibridan los orbitales dxy, dxz, dyz y s para dar 4 orbitales híbridos sd). En estos cuatro orbitales híbridos sd es donde se alojan los pares de electrones de los oxígenos ( marcados en rojo en la fig. 2) que forman enlace y además se forman dos enlaces π con los pares de electrones que se encuentran en el orbital p no hibridado del oxígeno (2 oxígenos tienen hibridación sp 3 (los enlazados con el sodio) y dos sp 2 (los que forman un doble enlace con el cromo, que son los que forman este enlace π y están representados por un asterisco en la figura 2 )). Esta estructura no es rígida, si no que es una estructura resonante en la que el doble enlace está repartido entre todos los oxígenos.
El producto resultante de la autoreacción es el Cr 3+, concretamente el hexaaquocomplejo[Cr(OH 2) 6] 3+. El Cr(III) tiene un estructura octaédrica y además, al reducirse ha ganado tres electrones que se colocan en los 3 orbitales d menos energéticos (dxy, dxz y dyz). Los orbitales más energéticos (dx 2-y 2 y dz 2) se hibridan junto con el orbital 4s y los 3 orbitales 4p con una hibridación d 2sp 3 para dar 6 orbitales con simetría octaédrica. En estos orbitales híbridos se forman los enlaces con los pares de electrones del agua (representados en rojo en la figura 3).
Y esto que he explicado tiene más que ver de lo que parece. A simple vista parece que ninguna, pero...
Si miramos detalladamente la estructura del CrO5, parece una estructura de un octaedro al que le hemos quitado un vértice. Si en este vértice añadimos una molécula de agua (recordemos que la reacción es en medio acuoso), ya tenemos un octaedro. Pero recordemos que el cromo (VI) es tetraédrico (el Cr(III) es octaédrico y el Cr(VI) tetraédrico) por lo que en medio acuoso, el CrO5 tenderá a reducirse a Cr(III) (otro motivo para la inestabilidad del compuesto).
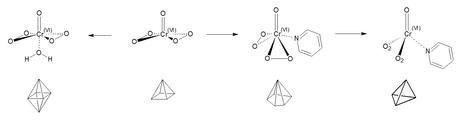
Ahora bien, hemos dicho que para estabilizarlo hay que añadir un disolvente orgánico como piridina, con lo que se forma el compuesto CrO(O 2)2-py, con estructura de pirámide de base pentagonal distorsionada. El Cr(VI) sigue teniendo estructura tetraédrica, pero ahora es más estable. Si entendemos la estructura del ligando peroxo como una única entidad, si que tenemos una estructura tetraédrica en un medio orgánico, que es la estructura con la que el Cr(VI) se encuentra cómodo. Y es este el motivo por el que en medio orgánico podemos estabilizar el compuesto.
Ahora os dejo un video de la Universidad de Nottingham donde el Profesor Martyn Poliakoff os explicará de manera gráfica como se produce la reacción:
Así que cuando vayamos por algún sitio y alguien no haga "cuernos", no es que esté maldiciéndonos, es que seguramente sea químico como nosotros.
