¡¡NUEVO POST!!
El agua es esencial para la vida tal como la conocemos. Las condiciones de este planeta permiten poder observar al líquido elemento en sus tres estados de agregación; sólido, líquido y gaseoso. El equilibrio entre ellos permiten a la vida desarrollarse y beneficiarse de su interrelación.
Enlaces intramoleculares
Estos estados se producen gracias a unos débiles enlaces comparados con las energías típicas de los enlace en las moléculas; los puentes de hidrógeno. La energía promedio para romper un puente de hidrógeno es de unos 40 kJ/mol, mientras que para romper los dos enlaces H-O de la molécula de agua se necesitan 930 kJ/mol.
La formación o rotura de estos enlaces son los que permiten pasar de un estado a otro.
Los puentes (o enlaces) de hidrógeno en el agua líquida están en continua rotura y formación por las traslaciones, rotaciones y vibraciones moleculares. Conforme aumenta la temperatura estos movimientos también, produciéndose una mayor rotura de puentes que produce el paso al estado gaseoso. Por contra, al disminuir la temperatura los movimientos disminuyen y por ende; se favorece la formación y vida de los puentes de hidrógeno entre las moléculas de agua. Esto da lugar a su solidificación y paso al estado sólido.
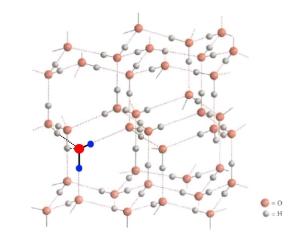
Estructura del hielo
El hielo posee una curiosa estructura. Cada átomo de oxígeno está enlazado a 4 átomos de hidrógeno, dos mediante enlaces covalentes y dos mediante puentes de hidrógeno. Estos se forman en línea recta aunque con cierta flexibilidad en unos 30º. Esta restricción más el ángulo de enlace de la propia molécula de agua produce que la red cristalina tenga enormes huecos. Este espacio vacío es el que produce la menor densidad del agua sólida respecto su líquido.
Conforme se va aumentando la temperatura las moléculas ganan movilidad. Así ciertas moléculas pueden romper los puentes de hidrógeno debido a ese mayor movimiento. Estas moléculas caen a los huecos produciendo un aumento de la densidad, ya que el agua líquida posee más moléculas por volumen que el hielo.
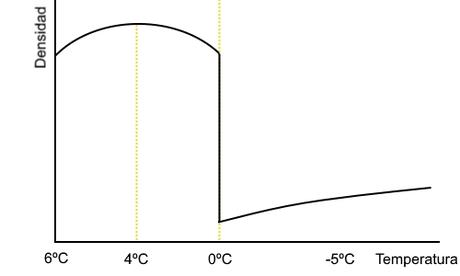
La temperatura sigue aumentando y más agua más densa se va formando, pero también comienza otro fenómeno; la expansión del agua con el aumento de temperatura. Esta expansión produce la disminución de la densidad. Se da una disputa entre el aumento de densidad del sólido al líquido y la disminución por la expansión. Se observa que de 0ºC a 4ºC predomina el primero y a partir de 4ºC el segundo.
Cómo congelar un lago
La superficie del lago es la que está en contacto con el exterior. Así al ir disminuyendo la temperatura en el medio esta parte es la primera en enfriarse. Conforme va bajando la temperatura, el agua superficial se va haciendo más densa y va desplazándose al fondo, siendo sustituida en superficie por la más caliente que antes se hallaba abajo. Este proceso se repite hasta que toda la masa de agua llega a una temperatura “constante” de 4ºC.
Si la temperatura exterior sigue bajando, entonces el agua superficial se sigue enfriando a menos de 4ºC y al ser la densidad de ese agua es menor se queda en la superficie. Sigue bajando la temperatura exterior y el agua superficial llega a los 0ºC, congelándose y formándose hielo. Este al ser mucho menos denso forma una capa protectora que impide la congelación de la masa completa del agua del lago.
Esto es esencial para la vida acuática en los climas frios, donde los animales y plantas se benefician de las propiedades físicas y químicas del agua.
La entrada De agua a hielo se publicó primero en Cardescu Web.

