
Deducción de la constante de
equilibrio desde las leyes de la cinética química, argumento material
A
diferencia de lo que uno podría pensar, la constante de equilibrio fue
enunciada en base a un argumento material y no en uno analítico, a pesar de que
muchas veces empleamos el argumento analítico para poder recordar más
fácilmente el modo en que se escribe de manera general la fórmula para la
definición de la constante de equilibrio.
El
argumento cinético desde el punto de vista material fue establecido en 1867 por
Cato Guldberg y Peter Waage. Para entender el argumento emplearemos un material
en reacción, por ejemplo la descomposición del tetraóxido de dinotrógeno en
dióxido de nitrógeno.
Esta
descomposición entable un estado de equilibrio, el punto de la cuestión es que
igual que modo se discutió en el artículo anterior, el modo en que se expresa
materialmente el equilibrio cambia dependiendo de las condiciones
termodinámicas de la mezcla en reacción, aquí variaremos la temperatura.
El
tetraóxido de dinitrógeno en solución acuosa es incoloro, mientras que el
dióxido de nitrógeno es de un color ocre que se torna rojizo a medida que su
concentración en la solución aumenta.
Esta
particularidad física nos otorga una manera de seguir la velocidad de la
reacción, así como el punto en que la reacción aparenta detenerse en el nivel
molar.
Sin
embargo, cuando los investigadores variaron la temperatura se dieron cuenta de
que el color de equilibrio alcanzado por la mezcla en reacción cambiaba, a
mayor temperatura la solución se tornaba más ocre y a menor temperatura se hacía
más transparente.

Figura DCE-01. Los tubos que muestran el cambio del estado de equilibrio dependiendo de la temperatura.
Estequimétricamente la descomposición de un mol de tetraoxido de dinitrógeno se descompone en dos moles de dióxido de nitrógeno.

Ya que esta reacción aparenta detenerse antes de que todo el reactive se consuma se la define como una reacción reversible susceptible de alcanzar un equilibrio “argumento material a nivel molar”
Ahora en el nivel molecular lo separamos en dos procesos, o dos reacciones, la reacción directa y la reacción inversa. Si tomamos en cuenta las gráficas de velocidad de la reacción para ambas reacciones nos damos cuenta de que aunque al inicio las velocidades de reacción son muy diferentes, con el paso del tiempo cuando se llega al equilibrio, las velocidades deben hacerse iguales. Este argumento grafico nos da uno de los axiomas principales del argumento cinético químico, las velocidades de las reacciones directa e inversa al alcanzar el equilibrio poseen el mismo valor:

Recordemos que, la ley de la velocidad de la reacción se expresa en primera instancia en términos de la actividad de dicha sustancia.
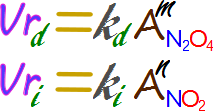
Ahora como tenemos soluciones acuosas la actividad se puede reemplazar por la concentración molar. Mientras que, al ser probablemente una reacción que se da en un solo paso en ambos sentidos asumiremos que el exponente es igual al coeficiente estequimétrico.
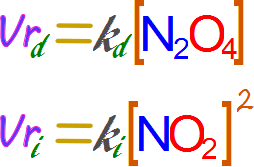
Si reemplazamos las velocidades por sus respectivas expresiones en la ley de la velocidad de reacción empleando las concentraciones iniciales y las respectivas constantes de proporcionalidad tenemos que:
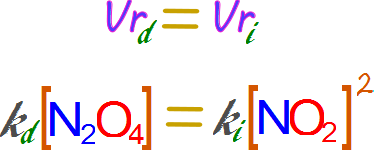
Donde kd es la constante de proporcionalidad de la reacción directa, y ki es la constante de proporcionalidad de la reacción inversa.
Ahora se reorganiza la expresión de modo que las constantes queden todas a la izquierda y las concentraciones queden todas a la derecha
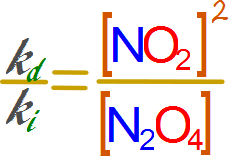
Aritméticamente, cuando una constante es dividida por otra constante el resultado es una tercera constante.
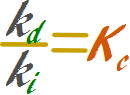
Esta tercer constante se denomina constante de equilibrio y se la expresa como Kc
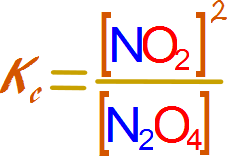
Dado que la constante de equilibrio se calcula a partir de los valores de las constantes de proporcionalidad de las velocidades de reacción de las reacciones directa e inversa, será susceptible de las mismas variables que estas dos, como las variables termodinámicas temperatura y presión PRINCIPAL REGRESAR
