 Cambio de la concentración como función del tiempo
Introducción al uso de la ecuación de velocidad de reacción química
Determinación experimental de la constante de proporcionalidad de una ecuación de velocidad de reacción química
Leyes de velocidad de reacción integrada: Reacciones de primer orden
Leyes de velocidad de reacción integrada: Reacciones de segundo orden
Leyes de velocidad de reacción integrada: Reacciones de orden cero
Vida media de una reacción
Cambio de la concentración como función del tiempo
Introducción al uso de la ecuación de velocidad de reacción química
Determinación experimental de la constante de proporcionalidad de una ecuación de velocidad de reacción química
Leyes de velocidad de reacción integrada: Reacciones de primer orden
Leyes de velocidad de reacción integrada: Reacciones de segundo orden
Leyes de velocidad de reacción integrada: Reacciones de orden cero
Vida media de una reacción
Graficando datos de cinética química Determinación experimental de la constante de proporcionalidad de una ecuación de velocidad de reacción química
De los elementos primordiales de la ley de la velocidad de reacción el que más resalta es la constante de proporcionalidad. Esta constante es muy importante ya que en ciertas reacciones se convertirá en uno de los fundamentos de otra constante, la constante de Equilibrio.
La determinación experimental de la ley de velocidad de reacción requiere que puedas encontrar el orden de la reacción con respecto cada uno de los reactivos y cualquier catalizador.
El método de las tasas de cambio iniciales es un método simple que permite obtener los órdenes de la reacción. Consiste en una serie de experimentos en los que las concentraciones iniciales de los reactivos se alteran.
Luego las tasas de cambio inicial se comparan, lo cual permite deducir los órdenes de la reacción. Para ver cómo funciona este método consideremos la siguiente reacción.

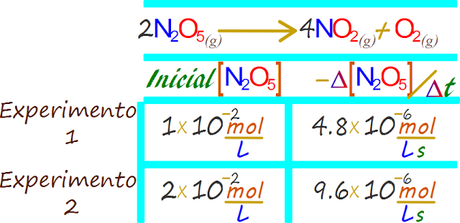
Esta reacción puede ser evaluada para su constante en dos experimentos. En el experimento 2 la concentración inicial del pentóxido de dinitrógeno es dos veces superior a la que se empleó en el experimento 1.
En cada uno de los casos se determina la tasa de consumo del pentóxido de dinitrógeno. Las concentraciones iniciales y las correspondientes tasas de cambio iniciales de los dos experimentos están consignadas en las siguientes tabla.
En primera instancia escribiremos la ley de la velocidad de la reacción teniendo en claro que el orden de la reacción es un valor desconocido (m)

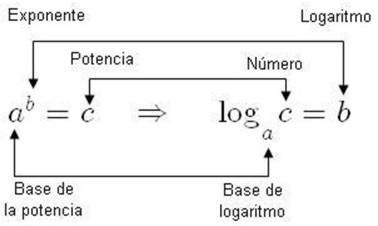
Ahora aplicamos la siguiente deducción
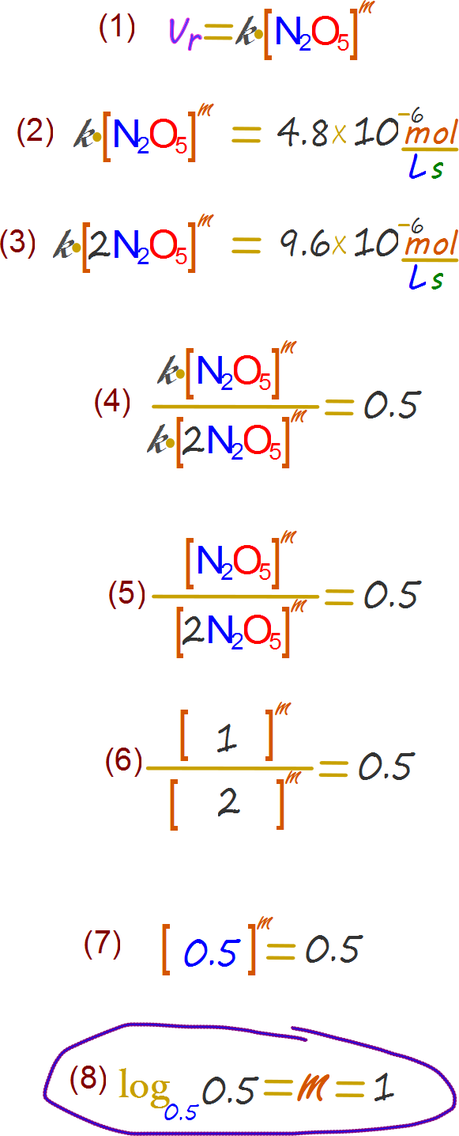
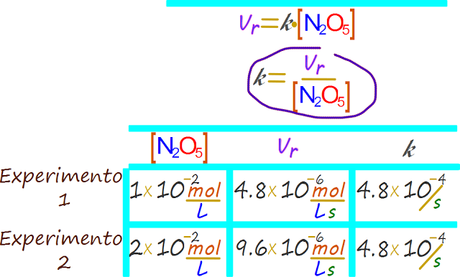
Así podemos escribir la ley de velocidad de reacción de la siguiente forma

El valor de K se obtiene mediante el reemplazo de las variables de concentración y velocidad para cualquier experimento realizado. Si se desea también se puede hacer para todos y luego sacar un valor promedio.
 PRINCIPAL
REGRESAR
PRINCIPAL
REGRESAR
