 La fuerza de los
ácidos y las bases
Fuerza relativa de
los ácidos y las bases
Determinando la
fuerza de un ácido de manera comparativa
Determinando la
fuerza de una base de manera comparativa
Estructura molecular
de la fuerza de los ácidos
Determinando la fuerza de un ácido
de manera comparativa
La fuerza de los
ácidos y las bases
Fuerza relativa de
los ácidos y las bases
Determinando la
fuerza de un ácido de manera comparativa
Determinando la
fuerza de una base de manera comparativa
Estructura molecular
de la fuerza de los ácidos
Determinando la fuerza de un ácido
de manera comparativa
Una reacción ácido base ocurre normalmente ocurre en la dirección del ácido más débil, es decir el ácido más fuerte se disocia y se sintetiza el más débil.
Es posible usar este hecho para comparar las fuerzas relativas de dos ácidos cualquiera.
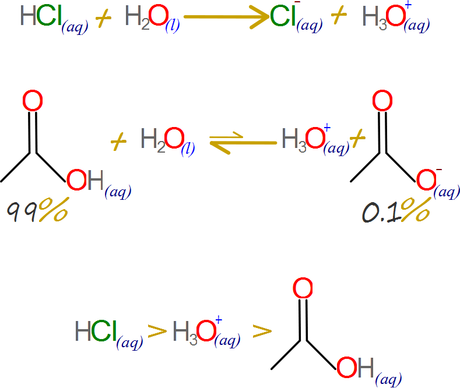
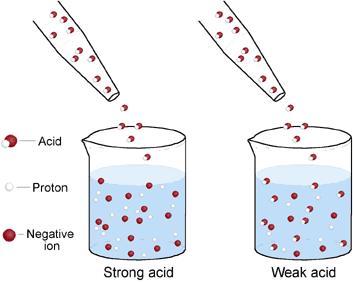
DFA-01. El ácido clorhídrico se disocia totalmente en agua, por lo que los protones se mantienen en su totalidad en los iones hidronio, y este al no tener una base al cual cederlos los retiene. El ácido etanoico es un ácido que no se disocia totalmente, una solución al 0.1 Molar de ácido etanóico solo consigue que el 1% de sus moléculas estén en la forma disociada, esto implica que el ion hidronio logra desprenderse de sus protones con gran eficiencia manteniéndolos en su mayoría en el ácido etanoico molecular, solo permitiendo que una leve fracción este disociada. De esta manera podemos establecer que el ácido clorhídrico es mas fuerte que el ion hidronio, y este a su vez es mas fuerte que el ácido etanóico.
El proceso de comparar la fuerza relativa de dos ácidos empleando el agua y al ion hidronio como intermediario no puede ser empleada para poder diferenciar la fuerza relativa de una pareja de ácidos fuertes “que se disocian completamente en agua” como el HCL y el HI.Sin embargo si se emplea un solvente menos básico que el agua “la cual es una base doble, pues el agua molecular y el grupo hidroxilo ambos pueden capturar protones” la resistencia que los ácidos encuentran a ceder sus protones se incrementan, lo que da lugar a que los ácidos revelen con más facilidad la capacidad de desprenderse de sus protones.
Un ejemplo de un solvente menos básico que el agua es el ácido acético, en este solvente ninguno de los dos ácidos logra disociarse completamente, pero el ácido yodhídrico puede disociarse con mayor facilidad que el clorhídrico, por lo cual se concluye que el ácido yodhídrico es mucho más fuerte. PRINCIPAL REGRESAR
