 La fuerza de los
ácidos y las bases
Fuerza relativa de
los ácidos y las bases
Determinando la
fuerza de un ácido de manera comparativa
Determinando la
fuerza de una base de manera comparativa
La fuerza de los
ácidos y las bases
Fuerza relativa de
los ácidos y las bases
Determinando la
fuerza de un ácido de manera comparativa
Determinando la
fuerza de una base de manera comparativa
Estructura molecular de la fuerza de los ácidos Determinando la fuerza de una base de manera comparativa
La misma reacción también se la puede entender desde el punto de vista de las bases en la reacción del ácido clorhídrico con el agua por ejemplo. Una base fuerte es aquella especie química que tiende a capturar protones con mayor eficiencia.
El agua en su equilibrio iónico despliega dos especies básicas, la más fuerte y al mismo tiempo la más rara es el grupo hidroxilo, la segunda base es el agua molecular. Ambas especies químicas son capaces de capturar protones y mantenerlos fijos con mayor facilidad que el ion cloruro. De hecho el ion cloruro posee una leve atracción hacia los protones debido a que la electronegatividad del cloro disminuye radicalmente una vez a adicionado un electrón extra a su última capa de electrones.
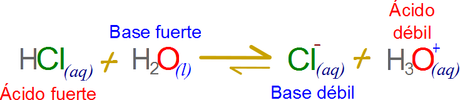
En tal caso la flecha de la reacción siempre apunta en la dirección de la base más fuerte a la base más débil. PRINCIPAL REGRESAR
