Ecuación de Arrhenius
Tomando las siguientes formulaciones

Y

Se puede establecer la ecuación de Arrhenius que relaciona de manera directa a la energía de activación y la temperatura con la constante de la velocidad de la reacción.

La variable A se denomina factor de frecuencia y se cree que es una constante, relaciona al producto del número absoluto de colisiones Z con la proporción que se hace en una configuración efectiva p.
Arrhenius publicó esta ecuación en 1889 sugiriendo que las moléculas requieren suficiente energía para activarse antes de poder realizar una reacción. Las teorías de colisión y estado de transición se basaron en este concepto fueron desarrollados durante las décadas de 1920 y 1930 respectivamente.
La ecuación de Arrhenius puede ser transformada empleando logaritmos, de este modo puede ser analogada a la ecuación de la recta, lo cual es útil para el trabajo en laboratorio ya que las variables pueden ser tabuladas y realizarse regresión lineal para calcular ciertos valores con validez estadística.
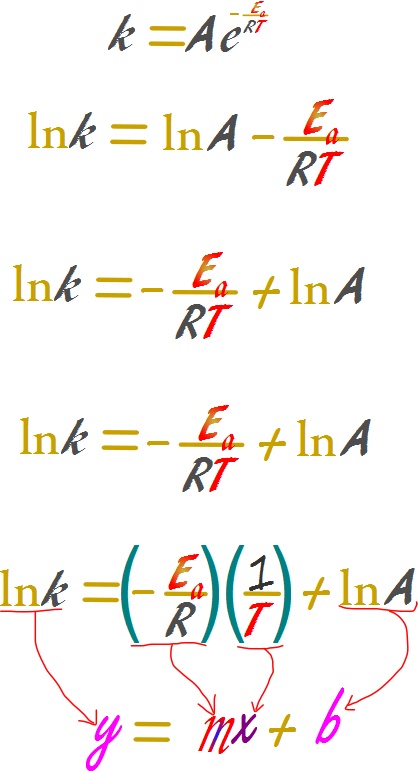
Esta ecuación puede emplearse para relacionar la energía de activación con la temperatura y la constante en dos estados de un sistema, uno inicial y otro final, la manipulación matemática permite omitir el factor A.
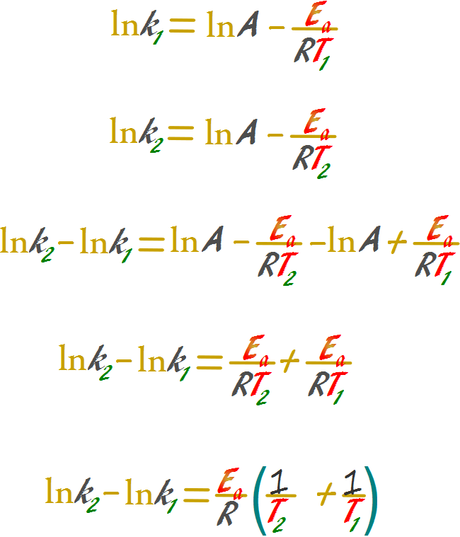 PRINCIPAL
REGRESAR
PRINCIPAL
REGRESAR
