 Estructura molecular de la fuerza de los ácidos
Efecto de la densidad electrónica en la fuerza de los ácidos
Fuerza de enlace y la fuerza de los ácidos binarios
Fuerza de enlace y la fuerza de los ácidos oxácidos
La estructura y la fuerza de los ácidos polipróticos
Efecto de la
densidad electrónica en la fuerza de los ácidos
Estructura molecular de la fuerza de los ácidos
Efecto de la densidad electrónica en la fuerza de los ácidos
Fuerza de enlace y la fuerza de los ácidos binarios
Fuerza de enlace y la fuerza de los ácidos oxácidos
La estructura y la fuerza de los ácidos polipróticos
Efecto de la
densidad electrónica en la fuerza de los ácidos
Pese a que la teoría de Lavoisier de los ácidos quedó obsoleta, si hay que decir que los oxígenos influencian fuertemente el comportamiento de los protones dentro de un ácido, pero igual, vamos por partes.
Para entender esto debemos recordar que entre más polar es un enlace y más tendiente al estado iónico es más fácil de fracturarlo. De esta forma cuando se analiza la estructura de un ácido debe prestarse especial atención al grupo de átomos que se encuentran al lado del protón pues todos lo afectan.
Muchos ácidos tienen sus protones muy cerca a los oxígenos, los cuales poseen regiones de densidad negativa muy alta, lo cual tiende a retener electrones y a liberar portones con mayor facilidad.
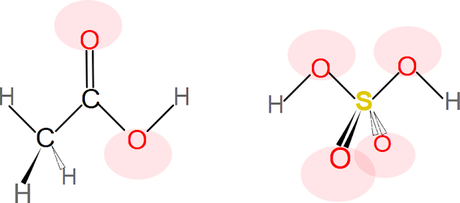
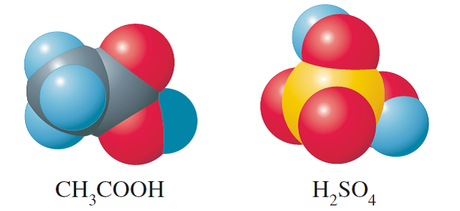
Figura EDE-01. El ácido acético "izquierda" tiene menos oxígenos y por lo tanto una menor densidad electrónica a su alrededor, el ácido sulfúrico es lo opuesto. Experimentalmente se ha determinado que los ácidos cuyas moléculas tienen sus protones asociados a mas átomos de oxígeno son mas fuertes.
En resumidas cuentas entre mas oxígenos y otros átomos de gran electronegatividad se encuentren cercanos al protón con mayor facilidad este se podrá retirar. PRINCIPAL REGRESAR
