Efecto de la presión en el equilibrio
La presión es un aspecto importante para los gases, pero debe ser a una temperatura constante. Si la temperatura es constante y el volumen es constante, la presión es directamente proporcional a la concentración y a la actividad del gas. Si se altera la temperatura o el volumen, la concentración del gas cambia, lo cual hace que su actividad cambia y por consiguiente sus velocidades de reacción y su constante de equilibrio.
El solo hecho de alterar el volumen o la temperatura puede hacer que una reacción en un equilibrio cambie para establecer un nuevo equilibrio.
¿Qué sucede si la presión se duplica en la metanación catalítica?
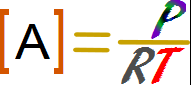
La presión es directamente proporcional a la concentración de un gas, por lo tanto si se duplica la presión la concentración también lo hace. Sucederá lo inverso si se disminuye la presión.
Calcularemos ahora una expresión general para el cambio de Qc en términos del cambio de concentraciones. Asumamos que alteramos la presión de las especies químicas n veces por igual, por ejemplo aumentando o disminuyendo el volumen.
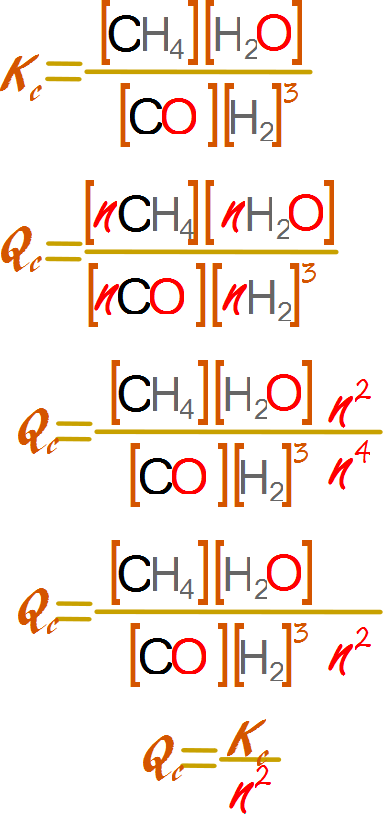
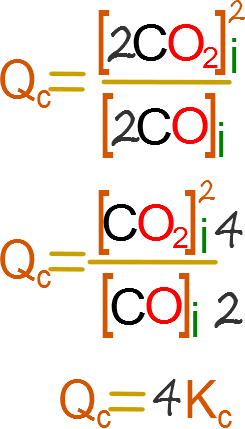
¿Qué sucede si la presión se duplica?
Al duplicarse la presión la concentración también se duplica, por lo que aplicando la formula general nos queda.
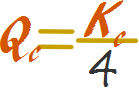
Es decir hay que dividir a la constante entre 4 para que sea igual a Qc, por lo tanto Qc es menor que la constante.

Si Qc es menor que la constante la reacción transcurre de manera directa favoreciéndose la síntesis de productos.
No todas las reacciones ocurren del mismo modo, observemos ahora una reacción en la que incrementamos la presión.
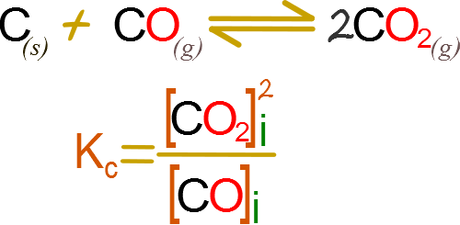
Asumamos que o duplicamos la masa del gas, o disminuimos el volumen a la mitad, en ambos casos obtenemos que la presión y por lo tanto la concentración molar se incrementan al doble.
Qc es cuatro veces mayor a la constante, por lo tanto la reacción va en la dirección de los reactivos.
De lo anterior se concluye que el cambio de presión afecta de manera específica a cada reacción, en algunos casos al incrementar la presión se puede favorecer la reacción directa y en otros la reacción inversa, todo dependerá de la estequiometria. PRINCIPAL
REGRESAR
