 Efecto de los
reactivos en las velocidades de reacción
Efecto de los
reactivos en las velocidades de reacción
Si bien la velocidad de la reacción es directamente proporcional a los productos e inversamente proporcional a los reactivos, esto no implica que las curvas generadas por la cantidad de sustancia de las especies químicas sean en sí, la tasa/velocidad de la reacción.
Experimentalmente, se ha encontrado que las tasas de reacción dependen de las concentraciones de los reactantes así como la concentración de los catalizadores, si es que los segundos están involucrados en la reacción.
Considere la reacción del dióxido de nitrógeno con flúor gaseoso para producir fluoruro de nitrilo.

La tasa de reacción se ha determinado como proporcional a la concentración del dióxido de nitrógeno. Cuando la concentración del dióxido de nitrógeno se duplica, la tasa de la reacción también se duplica.
La tasa de la reacción también es proporcional a la concentración del flúor gaseoso, duplicar la cantidad de flúor gaseoso duplica la tasa de la reacción.
Sin embargo esto no siempre es así, recordemos que todo depende del modo en que los materiales se nos presentan, por ejemplo los sólidos y los líquidos cuasi-puros no tienen efectos perceptibles en la velocidad de la reacción.
Cada reacción es única por lo que cada una tiene su propia velocidad determinada, incluso las unidades en las que se expresa esta velocidad de reacción cambian de una a otra dependiendo del estado en que se presentan los reactivos.
De forma general la velocidad de la reacción está determinada por la siguiente ley de proporcionalidad.
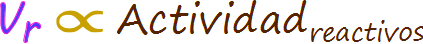
Figura ERR-01. La velocidad de una reacción es directamente proporcional a la actividad de los reactivos. La concentración molar es un tipo de actividad, pero no es la única.
Debido a que la velocidad de la reacción no depende de la cantidad de sustancia de todos los reactivos se reemplaza por el concepto de actividad, algunas sustancias serán más activas que otras a la hora de afectar las velocidades de la reacción.Para resolver la proporcionalidad y convertirlo en una relación aritmética debe adicionarse una constante de proporcionalidad de modo tal que las unidades cuadren.
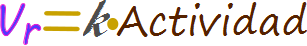
Figura ERR-02. Multiplicando la actividad por una constante única para cada reacción puede expresar de todo en términos de la velocidad de la reacción.
Las unidades de la constante k dependen de cada reacción. Por lo que, podemos escribir la velocidad de la reacción expresada al inicio del artículo en términos de la actividad de cada uno de sus reactivos.
Figura ERR-03. Ahora podemos expresar una ecuación mas cercana para la velocidad de la reacción expresada al inicio de este artículo.
Ahora, ¿cómo aterrizaremos las actividades en unidades que podamos trabajar en el laboratorio?, eso lo veremos en el siguiente artículo. PRINCIPAL REGRESAR
