A cierta temperatura el valor de la constante para la formación del ácido clorhídrico es de 49. Si en una vasija de 1 L se disponen 1.5 moles de HI, hallar las concentraciones de la mezcla de reacción en equilibrio a esa temperatura.
Determinar la reacción balanceada

Determinar la concentración de la especies al inicio de la reacción Son 1.5 moles de ácido en un volumen de 1 L, lo cual nos da una molaridad de 1.5

Determinar los valores de cambio
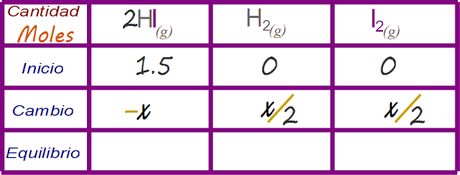
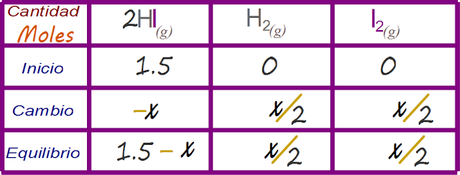
Determinar las expresiones algebraicas que representan la concentración de la especies en el estado de equilibrio
Escribir la expresión para la constante de equilibrio
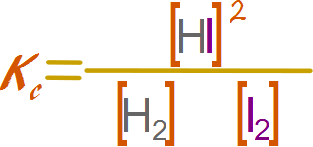
Resolver el problema algebraico
Reemplazaremos 1.5 por z para obtener una respuesta general que pueda reciclarse en ejercicios futuros.
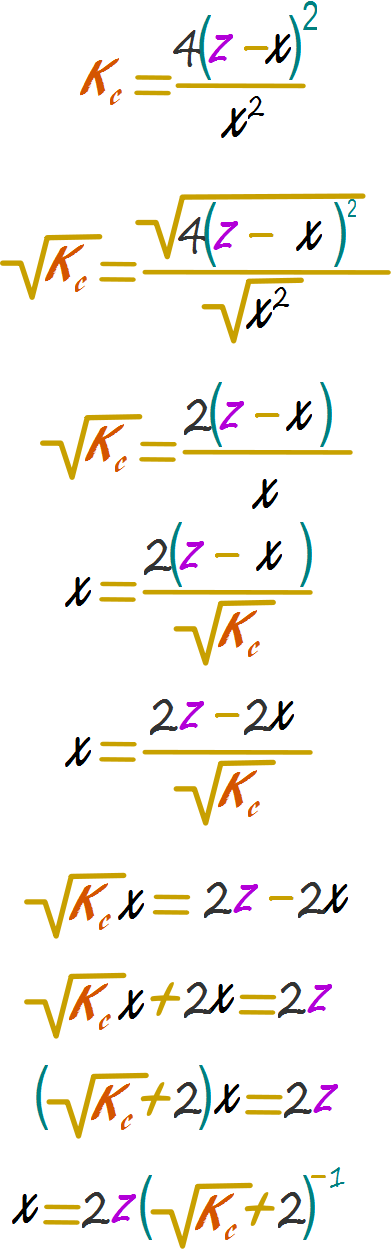
Reemplazar en la cuadrática y calcular el valor de x No es necesario emplear la cuadrática Usamos la siguiente tabla
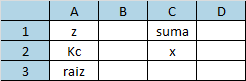
Colocamos las funciones adecuadas
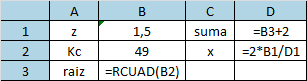
Y calculamos

Calcular las concentraciones El valor de x que se obtiene con la suma no tiene sentido químico, por lo tanto x = 0.33. De esta forma concluimos que la concentración del hidrógeno molecular gaseoso y el yodo molecular gaseoso es de 0.17 molar (17 moles/1L) y la concentración del ácido yodhídrico es de 1.17 molar (1.17 moles/L)
Cabe anotar que este problema está resuelto para cualquier valor de concentración de ácido Yodhídrico (z), repetir el mismo ejercicio con esta variable diferente solo implica reemplazar en la tabla y ya. PRINCIPAL
REGRESAR
