Ejercicio de equilibrio químico 3.
En un matraz se disponen 3g de bicarbonato de sodio y se hace vacío. Su capacidad es de un litro. Se calienta la mezcla a 100°C y la presión de equilibrio es de 1 atm. Calcular la cantidad de bicarbonato que se descompone.
Emplearemos la expresión de la constante en términos de las presiones.
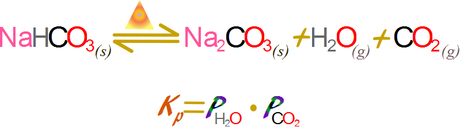
Si asumimos que en sistema no hay otros gases que el agua y el dióxido de carbono podemos emplear la ley de Dalton de las presiones parciales y la estequiometria para determinar la presión parcial de las especies.
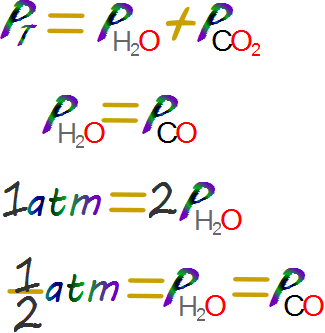
Con las presiones parciales y las condiciones termoquímicas se puede calcular la masa de dióxido de carbono o de agua que se generan.
Calcularemos los moles de agua a través de la ecuación de los gases ideales.
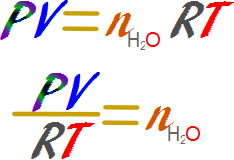
Reemplazamos y calculamos
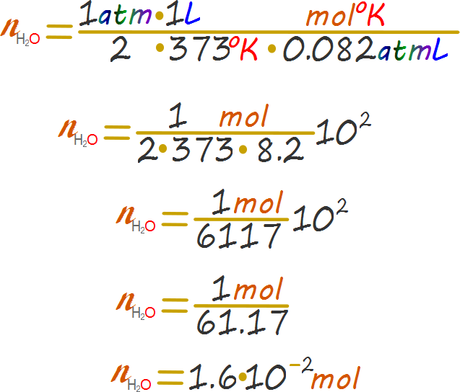
Por cada mol de agua se debieron consumir dos moles de bicarbonato. Finalmente obtenemos la masa perdida de bicarbonato al hacer la conversión a gramos.
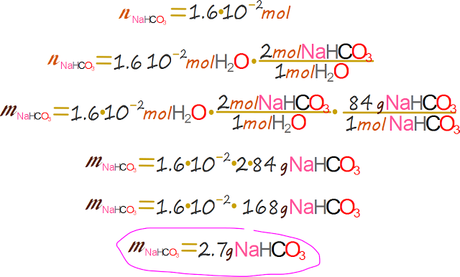
PRINCIPAL
REGRESAR
