Ejercicio de equilibrio químico 4.
Determinar cómo se afecta la síntesis de amoníaco (con un cambio de entalpia de -11Kcal/mol) a partir de hidrógeno gaseoso y nitrógeno gaseoso en términos de la concentración, la presión y la temperatura.
Primero determinaremos la expresión para la constante.
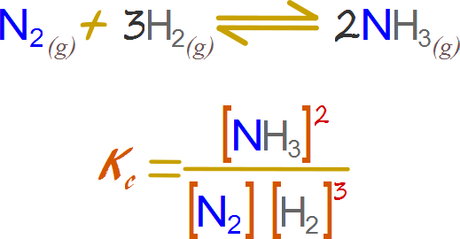
A- Concentración 1- Efecto de los reactivos: Aumento de reactivos al doble. La fracción se hace más grande que la constante, por lo tanto se favorece la reacción directa; si se disminuyeran los reactivos a la mitad se favorecería la reacción inversa.
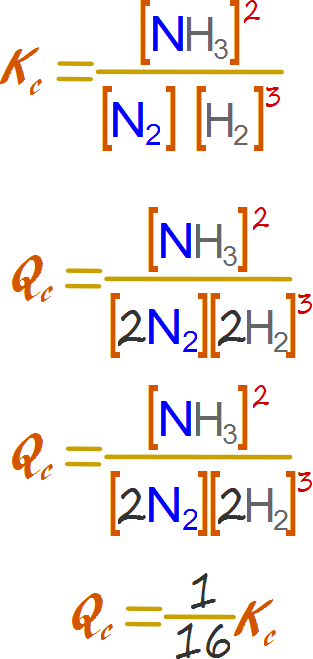
2-De manera contraria, incrementar a los reactivos favorece la reacción inversa y disminuirlos la reacción directa.
B- Presión: la presión es directamente proporcional a la presión, si aumenta la presión al doble aumenta la concentración al doble. Por lo tanto los cambios de presión en una especie tienen los mismos efectos que cambiar la concentración en esa especie en el mismo orden de magnitud. Aumentar la presión de reactivos favorece la reacción directa. Sin embargo esto es en términos de presiones parciales. Si se incrementa o disminuye la presión de todas las especies sucederá lo siguiente.
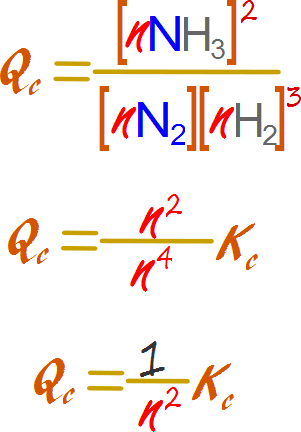
Aumentar la presión total hace que la fracción se haga más pequeña que la constante favoreciendo la reacción directa. Disminuir la presión tendrá un efecto inverso al favorecer la reacción inversa.
C- Temperatura. Es una reacción exotérmica, incrementar la temperatura favorece a la reacción inversa, y disminuir la temperatura la reacción directa.
D- Esta reacción se denomina proceso de Haber y como hemos podido concluir sus condiciones óptimas se basan en altas presiones y bajas temperaturas; sin embargo debido a que la velocidad de la reacción directa es muy baja se procede realmente a altas temperaturas para garantizar la síntesis en un tiempo prudencial al costo de bajos rendimientos. Este es un caso donde la velocidad de la reacción y el equilibrio plantean una relación antagónica que debe ser optimizada. PRINCIPAL
REGRESAR
