Hagamos una síntesis pedagógica con los recursos de la wiki sobre un método fiable y muy denostado por algunos fundamentalistas que ven en este método una seria amenaza en sus dogmas, hablemos por tanto del átomo de carbono. Efectivamente el átomo (del latín atomum, y éste del griego ἄτομον, sin partes) es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos. Hoy dia se acepta que el átomo se compone de un núcleo de carga positiva formado por protones y neutrones, alrededor del cual se encuentra una nube de electrones de carga negativa.
No existen dos átomos de un mismo elemento con características distintas y, en el caso de que estos posean masa distinta, pertenecen al mismo elemento pero en lo que se conoce como uno de sus isótopos, este nombre tan raro es el que le sirve a la ciencia para datar no sólo fósiles, y rocas del pasado sino para determinar incluso con absoluta precisión restos arqueológicos.
El núcleo más sencillo es el del hidrógeno, formado únicamente por un protón y un neutrón. El núcleo del siguiente elemento en la tabla periódica, el helio, se encuentra formado por dos protones y dos neutrones. Esto ocurre así básicamente con todos los elementos de la tabla periódica, de forma que a medida que aumenta el número de protones y neutrones también aumenta el de electrones, haciendo que cada vez que saltamos a un incremento de protones las propiedades del átomo sean tan distintas que lo que forma es un nuevo elemento.
De manera sencilla, un átomo por ejemplo de Oxígeno posee 8 protones, y su símbolo en Química es O, de manera estable el resultado de la suma de sus neutrones y sus protones 8+8=16 da un número másico (suma de protones y neutrones) de 16. Por otro lado tenemos los electrones que giran con carga opuesta (negativa) a la del núcleo. Para entender esto los científicos y la ciencia han ido encadenando una serie de modelos teóricos que explicaban o intentaban explicar cómo era el átomo, desde el modelo de Dalton hasta el de Schrödinger, pasando por Thomson, Rutherford o Bohr. Actualmente se considera que el átomo como un núcleo de protones , neutrones y electrones girando en torno a él pero no exactamente como el concepto de átomo que todos tenemos en la cabeza (modelo de Rutherford), sino como una función de onda que calcula la probabilidad de presencia de una partícula (modelo de Schrödinger).
Para entender esto los científicos y la ciencia han ido encadenando una serie de modelos teóricos que explicaban o intentaban explicar cómo era el átomo, desde el modelo de Dalton hasta el de Schrödinger, pasando por Thomson, Rutherford o Bohr. Actualmente se considera que el átomo como un núcleo de protones , neutrones y electrones girando en torno a él pero no exactamente como el concepto de átomo que todos tenemos en la cabeza (modelo de Rutherford), sino como una función de onda que calcula la probabilidad de presencia de una partícula (modelo de Schrödinger).
Pero, pasemos esto y centrémonos en el objetivo explicar el C14. Cómo dije antes existen también átomos que tienen el mismo número atómico, pero diferente número másico, los cuales se conocen como isótopos. Los átomos que son isótopos entre sí son los que tienen igual número atómico (número de protones en el núcleo) pero diferente número másico (suma del número de neutrones y el de protones en el núcleo). Por lo tanto difieren en el número de neutrones. Por ejemplo, existen tres isótopos naturales del hidrógeno, el protio (1H), el deuterio (2H) y el tritio (3H). Todos poseen las mismas propiedades químicas del hidrógeno, y pueden ser diferenciados únicamente por ciertas propiedades físicas. modelo de Schrödinger
modelo de Schrödinger
Características del C14
El carbono es un elemento notable por varias razones. Sus formas alotrópicas incluyen, sorprendentemente, una de las sustancias más blandas (el grafito) y la más dura (el diamante) y, desde el punto de vista económico, uno de los materiales más baratos (carbón) y uno de los más caros (diamante). Más aún, presenta una gran afinidad para enlazarse químicamente con otros átomos pequeños, incluyendo otros átomos de carbono con los que puede formar largas cadenas, y su pequeño radio atómico le permite formar enlaces múltiples. En definitiva es el elemento más versátil en cuanto a capacidad para formar moléculas de hecho la bioquímica de la vida se sustenta arquitectónicamente bajo este elemento.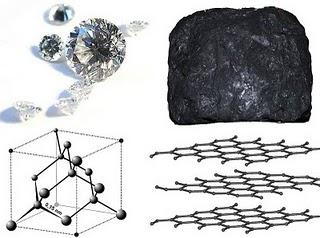
Pero el carbono presenta varios isótopos, carbono-14 es un radioisótopo con un periodo de semidesintegración de 5730 años que se emplea de forma extensiva en la datación de especímenes orgánicos.
Los isótopos naturales y estables del carbono son el 12C (98,89%) y el 13C (1,11%). Sin embargo existe el carbono-14 (14C) un radioisótopo del carbono. Su núcleo contiene 6 protones y 8 neutrones, por lo tanto son variantes de un elemento que difieren en el número de neutrones que poseen. La diferencia de los Radioisótopos con el resto de isótopos es que su núcleo atómico es Radiactivo. Esto se debe a tener un mal balance entre neutrones y protones. Para compensar esto el núcleo ha de emitir radiación para desexcitar el núcleo, transmutándolo en un elemento estable u otro isótopo radiactivo. 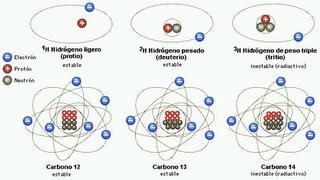
Cada radioisótopo tiene un periodo de semidesintegración o semivida características. Por ejemplo en el caso de los isótopos del Oxígeno su vida media de vida son solo 3 minutos, este proceso obviamente desprende energía.
Aunque la formación de los isótopos es muy variada y compleja algunos se forman de manera continua en la atmósfera por acción de los rayos solares como el del oxígeno o el del carbono, otros tales como los de uranio se formaron en el interior de las estrellas o en condiciones particulares del interior del planeta y todavía están ahí porque su periodo de desintegración es tan alto que aún están entre nosotros.
Vale y todo esto ¿para qué nos sirve?
El método de datación por radiocarbono es la técnica basada en isótopos más fiable para conocer la edad de muestras orgánicas de menos de 6.000 años. Está basado en la ley de decaimiento exponencial de los isótopos radiactivos. El isótopo carbono-14 (14C) es producido de forma continua en la atmósfera como consecuencia del bombardeo de átomos de nitrógeno por neutrones cósmicos. Este isótopo creado es inestable, por lo que, espontáneamente, se transmuta en nitrógeno-14 (14N). Estos procesos de generación-degradación de 14C se encuentran prácticamente equilibrados, de manera que el isótopo se encuentra homogéneamente mezclado con los átomos no radiactivos en el dióxido de carbono de la atmósfera. El proceso de fotosíntesis incorpora el átomo radiactivo en las plantas, de manera que la proporción 14C/12C en éstas es similar a la atmosférica. Los animales incorporan, por ingestión, el carbono de las plantas. Ahora bien, tras la muerte de un organismo vivo no se incorporan nuevos átomos de 14C a los tejidos, y la concentración del isótopo va decreciendo conforme va transformándose en 14N por decaimiento radiactivo.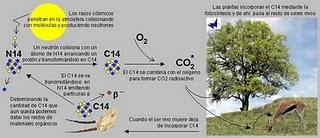
La masa en isótopo 14C de cualquier espécimen disminuye a un ritmo exponencial, que como he comentado antes es de 5730 años, a partir de la muerte de un ser vivo la cantidad de 14C en sus restos se va reduciendo poco a poco a ritmo constante y conocido. Así pues, al medir la cantidad de radiactividad en una muestra de origen orgánico, se calcula la cantidad de 14C que aún queda en el material. Así puede ser datado el momento de la muerte del organismo correspondiente. Es lo que se conoce como "edad radiocarbónica" o de 14C, y se expresa en años BP (Before Present). Esta escala equivale a los años transcurridos desde la muerte del ejemplar hasta el año 1950 de nuestro calendario.
Al comparar las concentraciones teóricas de 14C con las de muestras de maderas de edades conocidas mediante dendrocronología, se descubrió que existían diferencias con los resultados esperados. Esas diferencias se deben a que la concentración de carbono radiactivo en la atmósfera también ha variado respecto al tiempo. Hoy se conoce con suficiente precisión (un margen de error de entre 1 y 10 años) la evolución de la concentración de 14C en los últimos 15.000 años, por lo que puede corregirse esa estimación de edad comparándolo con curvas obtenidas mediante interpolación de datos conocidos. La edad así hallada se denomina "edad calibrada" y se expresa en años Cal BP. Pero ¡ojo!, no sólo se dispone del carbono, también el potasio y otros elementos con radioisótopos de desintegración lenta que pueden usarse para escalas mucho más amplias.
Y para terminar...
Pues sí, ¡así funciona la ciencia!
Fuentes: Wikipedia y el muy recomendable canal de ajuiciado

