
En esta entrada vamos a seguir trabajando todo aquello relacionado con los fallos derivados de la tabla periódica. En este caso vamos a tratar algo que muchas personas confunden, que es el concepto de elemento de bloque d y elemento de transición.
En un libro de Bachillerato encontré la siguiente definición de elementos de transición: “Tienen el electrón diferenciador en un orbital d (del penúltimo nivel ocupado). Ocupan la parte central del sistema periódico. Comprenden diez grupos (del 3 al 12) con una estructura electrónica externa que, salvo excepciones, varía desde (n-1)d1 ns2hasta (n-1)d10ns2”
En otro libro de Bachillerato, en vez de aparecer la palabra elementos de transición, aparece la palabra metales de transición … bueno son elementos de la tabla periódica y son metales así que da igual que nos refiramos a ellos como elementos de transición como metales de transición, y la definición que aparece es la siguiente: “Bajo este nombre se recogen los grupos del 3 al 12 (antiguamente simbolizados por la letra B) que contienen aquellos elementos cuyo electrón diferenciador se aloja en un orbital de tipo d. La configuración electrónica de su capa de valencia es: ns2(n-1)dx (X=1,2 … 10) . Como se puede observar ambas definiciones son muy parecidas.
Para hacerlo gráfico y sencillo de entender, a continuación, voy a poner una imagen de la tabla periódica en la que indico según esta definición que elementos son elementos de transición.
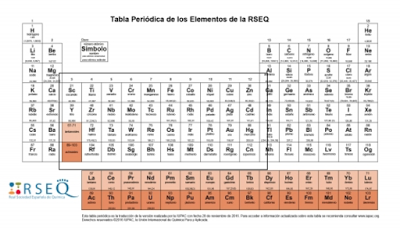 Pero posteriormente hacemos un curso de química más avanzada que la química de bachillerato, en concreto un curso de química inorgánica. Por ejemplo, cursamos la química inorgánica III del grado en química en la USC (Universidad de Santiago de Compostela) y nos dicen que ¡OJO! ¡CUIDADO! ¡PELIGRO!Que no confundamos metal de transición con elemento del bloque d y nos dan las siguientes definiciones:
Pero posteriormente hacemos un curso de química más avanzada que la química de bachillerato, en concreto un curso de química inorgánica. Por ejemplo, cursamos la química inorgánica III del grado en química en la USC (Universidad de Santiago de Compostela) y nos dicen que ¡OJO! ¡CUIDADO! ¡PELIGRO!Que no confundamos metal de transición con elemento del bloque d y nos dan las siguientes definiciones:- Metal de transición: Son los metales que pertenecen a los grupos del 3 al 11. Se llaman así porque tienen una transición en sus propiedades. La definición comúnmente aceptada de metal de transición es un elemento que forma por lo menos un ión simple con un conjunto incompleto de electrones d exteriores. Esta definición excluye los elementos del grupo 12 (zinc, cadmio y mercurio) porque estos metales siempre mantienen una configuración electrónica d10.- Metal del bloque d: Son todos los elementos del bloque d de la tabla periódica (grupos del 3 al 12) y que tienen configuración electrónica (n-1)dxns2.Que gráficamente significan esto:
 El recuadro rojo engloba a los metales de transición y el recuadro negro engloba a los metales del bloque d. Si miramos la imagen anterior observaremos, que realmente lo que estaba marcando eran los metales del bloque d, y ahí está el motivo de ¡OJO! ¡CUIDADO! ¡PELIGRO! ¡NO CONFUNDIR METAL DE TRANSICIÓN CON METAL DEL BLOQUE D!Ya que por algún motivo que yo desconozco, en bachillerato se nos da una definición de metales de transición que no es correcta. Es posible que esta definición sea antigua, o que sea una de esas cosas que nos cuentan en bachillerato que no son del todo ciertas, pero con nuestros conocimientos de químicos no nos queda más remedio que creérnoslo así … Acepto comentarios sobre este tema.
El recuadro rojo engloba a los metales de transición y el recuadro negro engloba a los metales del bloque d. Si miramos la imagen anterior observaremos, que realmente lo que estaba marcando eran los metales del bloque d, y ahí está el motivo de ¡OJO! ¡CUIDADO! ¡PELIGRO! ¡NO CONFUNDIR METAL DE TRANSICIÓN CON METAL DEL BLOQUE D!Ya que por algún motivo que yo desconozco, en bachillerato se nos da una definición de metales de transición que no es correcta. Es posible que esta definición sea antigua, o que sea una de esas cosas que nos cuentan en bachillerato que no son del todo ciertas, pero con nuestros conocimientos de químicos no nos queda más remedio que creérnoslo así … Acepto comentarios sobre este tema. La conclusión a la que llegamos es que cinc, cadmio y mercurio no son metales de transición, pero si son metales del bloque d.
Bibliografía:-Dominguez Real M. Química -Editorial Consorcio. Tema 1-Del Barrio J.I, Bárcena A.I, Sánchez A., Caamaño A., Física y química editorial SM. Tema 2-Apuntes de Química Inorgánica III
24/01/2018Descubrirlaquimica. Estudiante de química en la USC
 Esta entrada participa en la LXVI Edición del Carnaval de Química, Disprosio. Alojada en el blog Ciencia en Común de @jserranodf.
Esta entrada participa en la LXVI Edición del Carnaval de Química, Disprosio. Alojada en el blog Ciencia en Común de @jserranodf.

