Entropía en química Introducción a la entropía química Microestados y entropía química Cambio de entropía de un sistema químico Entropia estandar La segunda ley de la termodinámica en términos matemáticos Entropía de la reacción y entropía del sistema Entropía de los alrededores Entropía de los alrededores
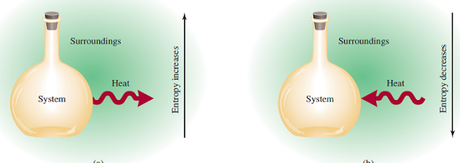
Gracias a a entalpia sabemos cuanta energía puede generar una reacción química, lo cual tiene ciertas implicaciones. Si es una reacción que genera energía se crea un cambio en la entropia de los alrededores que es inverso a la entropía en el interior, si la reacción genera entalpia, los alrededores la absorben.
También sabemos que la entropía se incrementa con la temperatura, por lo que al absorberse entalpia la entropía aumenta.
Es una relación negativa, mientras que el sistema emite energía “perdiéndola” los alrededores la captan ganándola, lo que implica una relación de proporcionalidad:
 E
cambio en la entropía de los alrededores es el negativo proporcional del cambio
de entalpia de la reacción. Falta una variable de proporcionalidad que ajuste
las unidades y esa es el inverso de la temperatura.
E
cambio en la entropía de los alrededores es el negativo proporcional del cambio
de entalpia de la reacción. Falta una variable de proporcionalidad que ajuste
las unidades y esa es el inverso de la temperatura.
Expresémoslo del siguiente modo, digamos que tenemos un flujo de energía en el que la entalpia no cambia perceptiblemente, ¿qué pasa con la energía que fluye desde el recipiente de la reacción a los alrededores?, pues incrementará la temperatura.

Del mismo modo, si la temperatura no se incrementa lo hará la dispersión de partículas de los alrededores, es decir incrementa la entropía de los alrededores.
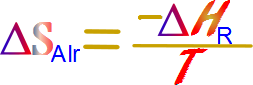
De este modo obtenemos la fórmula para el cálculo de la entropía de los alrededores en términos de la entalpia y la temperatura
Dado que ya sabemos calcular el cambio en la entalpia de la reacción solo nos resta enunciar que por lo general T es a las condiciones estándar 25°C PRINCIPAL REGRESAR
