Equilibrios estáticos contra equilibrios dinámicos
Desde el punto de vista molar “macroscópico” una reacción que ingresa en equilibrio es incapaz de consumir todos sus reactivos, más aun cuando se adicionan productos a la mezcla de reacción el sistema ¡empezará a producir reactivos!
Sin embargo el nivel molar genera una especie de estasis cuando se alcanza el equilibrio, como si la reacción se detuviese. Los modelos moleculares que se han ideado para explicar las propiedades de las reacciones en equilibrio establecen que esta estasis es solo aparente, y que las dos reacciones que se involucran durante el equilibrio siempre se están dando, solo que los productos y reactivos sintetizados en cada dirección se forman y destruyen en cantidades iguales o cercanas a la igualdad.
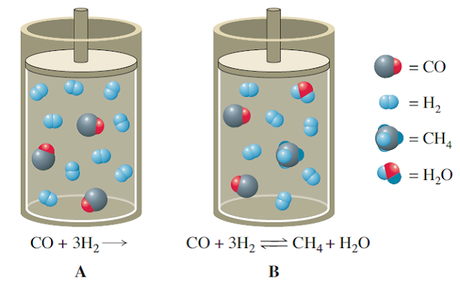
Consideremos ahora la metanación catalítica, reacción que fue introducida en el artículo anterior. Esta consiste en una reacción directa y una reacción inversa, y se la presenta del modo que fue expuesto en la introducción del tema, mediante una doble flecha que representa que las dos reacciones ocurren de manera simultánea.

Asumamos que en el reactor ajustamos las condiciones termodinámicas para que se favorezca la reacción directa lo más que se pueda. Si se tiene una cantidad de reactivos al inicio y cero cantidad de productos la velocidad de la reacción al inicio es muy alta, pero va decreciendo con forme se empieza a sintetizar productos hasta llegar a un punto en que las cantidades de todas las especies químicas se estabilizan, esto es denominado el punto de equilibrio.
De esta manera podemos definir al equilibrio químico como el estado que se alcanza por la mezcla de la reacción cuando las velocidades de la reacción directa e inversa son iguales.
Sin embargo, dado que a nivel molecular la reacción nunca se detiene es posible alterar las cantidades de productos y reactivos mediante tres procedimientos, el primero es alterar la cantidad de reactivo, la segunda alterar la cantidad de producto y la última es alterar las condiciones termodinámicas. Cada uno de estas tres variables puede alterar las condiciones de equilibrio a favor o en contra de reactivos o de productos.
Si se estandarizan las condiciones termodinámicas, es posible predecir las cantidades de especies químicas en la mezcla de la reacción a partir de las cantidades de los reactivos de inicio. Nuevamente el modelo se simplifica en el sentido de que no se calculan las cantidades de sustancias durante el periodo de tiempo en que la mezcla de la reacción no ha alcanzado el equilibrio.

Figura EED-01. Dos gráficas determinan el estado de equilibrio. a la izquierda tenemos una de cantidad de sustancia contra tiempo, esta es importante porque señala que en un equilibrio químico no necesariamente se produce la mitad de sustancia entre reactivos y productos, en realidad la cantidad de sustancia puede ser cualquiera, lo que interesa es el punto donde el cambio de cantidad de sustancia ya no se da generándose una linea horizontal permanente a lo largo del tiempo, este es el estado de equilibrio. La gráfica de la derecha representa velocidad de la reacción contra tiempo, en este caso ambas gráficas tieden a igualarse, y el estado de equilibrio se alcanza cuando la velocidad de la reacción de ambas se hace la misma.
Dado que para poder calcular las concentraciones en el equilibrio se requiere del conocimiento de las condiciones termodinámicas bajo las cuales se entabla uno u otro equilibrio es posible decir que todo dependerá de las constantes de proporcionalidad de la constante de la reacción. PRINCIPAL
REGRESAR
