Equilibrios químicos heterogéneos
y homogéneos
Un
equilibrio homogéneo es aquel en el que los reactantes y los productos se
encuentra en un mismo estado de la materia, es decir en una misma fase.
La
metanación catalítica es un ejemplo de un equilibrio homogéneo pues todas las
especies químicas en la mezcla de la reacción se encuentran en fase gaseosa.
Un
equilibrio heterogéneo por el contrario es aquel en el que las especies
químicas de la mezcla de la reacción se encuentran en diferentes estados de la
materia, es decir en diferentes estados químicos.
Tomemos
por ejemplo el caso de la oxidación del hierro metálico por parte del vapor de
agua para producir tetraóxido de trihierro y gas de hidrógeno molecular.

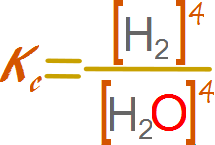
Como
ya se ha mencionado anteriormente los sólidos y líquidos puros su actividad se
expresa como 1. De este modo la constante de equilibrio se escribe del siguiente
modo.
La
cantidad de unidades por volumen en los líquidos y solidos puros es constante a
una temperatura dada, a diferencia de lo que ocurre con las soluciones acuosas
y los gases cuyos valores cambian.
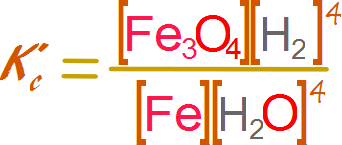
Para
entender porque los valores contantes se omite de la expresión de equilibrio,
escribiremos una expresión para la constante de equilibrio incluyendo a las especies
solidas a la cual llamaremos constante de equilibrio prima.
Reemplazamos los valores de las especies químicas
constantes por expresiones de constantes k
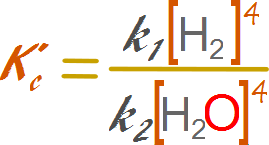
Reorganizamos la expresión de modo tal de
dejar las variables a un lado y las constantes al otro.
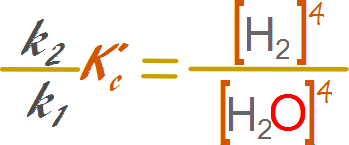
De
esta manera los valores de la actividad de los sólidos y líquidos puros se incorporan
a la constante de equilibrio de manera directa.
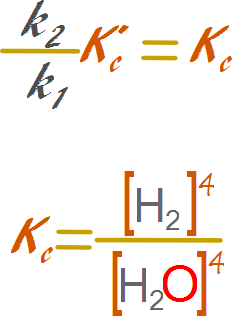
PRINCIPAL
