 Escritura de la
ecuación de la velocidad de la reacción
Escritura de la
ecuación de la velocidad de la reacción
Tomemos ahora como ejemplo la reacción hipotética universal

Y ahora escribamos la ecuación que represente su velocidad de reacción.

Los términos de la anterior ecuación son la constante, las actividades y los exponentes.
La constante:
Depende de cada reacción y está consignada en tablas de reacciones químicas. Las unidades cambian dependiendo del estado de la materia en que se presentan los componentes de la reacción.
La actividad:
La actividad se mide dependiendo de cómo se presenta la sustancia en la reacción.
1-Actividad de líquidos y sólidos puros: es igual a 1 debido a su pureza.
2-Actividad de sustancias en soluciones: concentraciones molares. Recordando.

Sin embargo para no tener que escribir siempre las unidades se ha determinado que si se tiene el símbolo del elemento encerrado en corchetes, equivale a expresarlo en concentración molar.
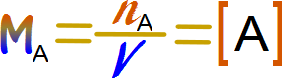
3-Actividad de los gases: En unidades de presión. Esto se debe a que la presión es directamente proporcional a la concentración molar, siempre y cuando el volumen esté expresado en litros.

Cabe destacar que este juego matemático solo implica que la presión es directamente proporcional a lo que sería una molaridad y por eso se la puede usar como la actividad de las especies gaseosas, sin embargo como el solvente de los gases es el aire no puede decirse que estos puedan expresarse en términos de una molaridad.
Los exponentes:
Los exponentes deben determinarse experimentalmente y no necesariamente son los mismos valores de los coeficientes estequiométricos. PRINCIPAL REGRESAR
