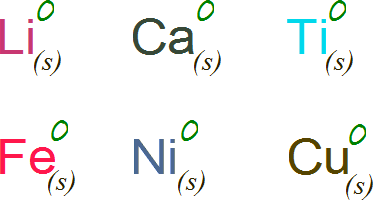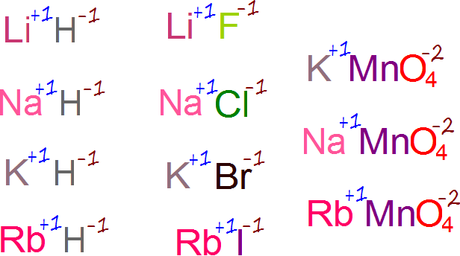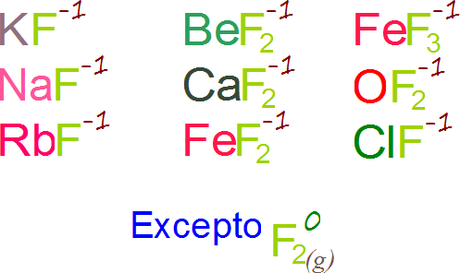Pozo de la Quinta da Regaleira - Sintra (Portugal) - Fotografía
realizada desde el interior del pozo

En esta imagen se muestra una tabla periódica. Es importante tenerla presente para este artículo. Se denominan grupos a las columnas de la tabla periódica y períodos a las filas. Los períodos se numeran del 1 al 7, los grupos del 1 al 18, es posible que en algunas tablas periódicas aparezcan nombrados con con números romanos
La valencia o estado de oxidación de un elemento, es el número teórico que indica los electrones que el átomo puede perder, ganar o compartir cuándo se une a otro átomo para formar una molécula de compuesto.
- El estado de oxidación de un elemento libre es 0.
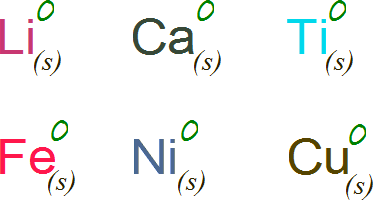
- En sus compuestos, los elementos de los grupos 1 y 2, tienen como única valencia la del número del grupo al que pertenecen. Los del grupo 1, +1 y los del grupo 2, +2.
- En sus compuestos , los elementos de los grupos 3 y 13, tienen valencia +3.
- Los elementos del grupo 18 no tienen valencias, son los gases nobles, que no forman elementos
- El hidrógeno siempre tiene estado de oxidación +1, salvo en los hidruros iónicos, en los que su estado de oxidación es -1.
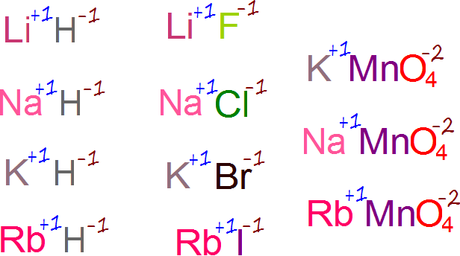
- EN SUS COMPUESTOS, EL ESTADO DE OXIDACIÓN DEL FLÚOR ES -1.
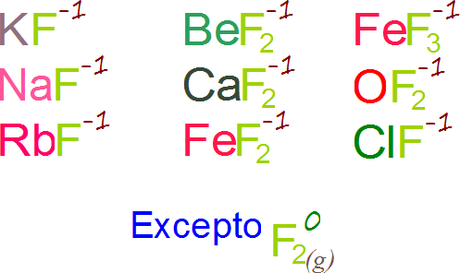
- La suma total de los estados de oxidación en todos los átomos es: en un compuesto neutro 0 y en una especie iónica la carga del ión.

CONOCIENDO ESTAS REGLAS PODEMOS DETERMINAR EL ESTADO DE OXIDACIÓN DE CUALQUIER ELEMENTO EN CUALQUIER COMPUESTO:

Cuándo expresamos el estado de oxidación de un elemento lo podemos hacer de dos maneras:
- Poniéndolo entre paréntesis con números árabes, especificando la carga. Por ejemplo: El estado de oxidación del calcio es calcio (+2).
- Poniéndolo entre paréntesis con números romanos, sólo especificaremos la carga cuándo esta sea negativa. Por ejemplo el estado de oxidación del flúor es (-I).